第七章
原子吸收光谱法
Atomic Absorption
Spectrometry,AAS
7.1 概述
原子吸收光谱法是基于测量待测元素的基态原子对其特征谱线的吸收程度而建立起来的定量分析方法。又称原子吸收分光光度法,简称原子吸收法。
原子吸收法是20世纪50年代之后发展起来的一种新型仪器分析方法。到目前为止,它已广泛用于材料科学、环境科学、医药食品、农林产品、生物资源开发和生命科学等各个方面。特别是在分析与农、林、水科学有密切关系的微量元素工作中发挥了很大的作用。
原子吸收光谱法之所以发展迅速,是因为它本身具有以下许多特殊的优点:
(1)灵敏度高 原子吸收法测定的绝对灵敏度可达10-13 ~10-
(2)选择性好 原子吸收是基于待测元素对其特征谱线的吸收,因此干扰较少,易于消除。
(3)精密度和准确度高 由于原子吸收程度受外界因素的影响相对较小,因此一般具有较高的精密度和准确度。
(4)测定元素多 能够用原子吸收光谱法测定的元素多达70多种。
(5)需样量少、分析速度快。
传统原子吸收光谱法的不足之处是测定不同元素用不同的灯,更换不太方便。新型多通道原子吸收光谱法中虽然在一定程度上解决了此问题,但价格比较昂贵。另外,对多数非金属元素还不能直接测定。不能同时进行多元素分析。
本章还将讨论原子荧光光谱法。
7.2 基本原理
通常情况下,原子处于基态,当通过基态原子的某辐射线所具有的能量(或频率)恰好符合该原子从基态跃迁到激发态所需的能量(或频率)时,该基态原子就会从入射辐射中吸收能量,产生原子吸收光谱。原子的能级是量子化的,所以原子对不同频率辐射的吸收也是有选择的。例如基态钠原子可吸收波长为589.00nm的光量子;镁原子可吸收波长为285.21nm的光量子。这种选择性吸收的定量关系服从下式:
△E=
h![]() = h
= h![]()
原子由基态跃迁到第一电子激发态所需能量最低,跃迁最容易(这时产生的吸收线称为主共振吸收线或第一共振吸收线),因此大多数元素主共振线就是该元素的灵敏线。也是原子吸收法中最主要的分析线。
原子吸收光谱法是利用待测元素的基态原子对其特征谱线的吸收。
在原子吸收光谱中,一般是将试样在2000~3000K的温度下进行原子化,其中大多数化合物被蒸发,解离,使元素转变为原子状态,包括激发态原子和基态原子。根据热力学原理,在温度T一定,并达到热平衡时,激发态原子数Nj与基态原子数N0的比值服从波尔兹曼(Bolezmann)分布规律,可用波尔兹曼方程式表示:
![]() =
=![]()
![]() (7.1)
(7.1)
在原子光谱中,由元素的谱线的波长即可知道相应的Pj/P0和DE,由此可以计算出一定温度下的Nj/ N0比值,表6-1列出四种元素在不同温度下的Nj / N0值。
表7.1 四种元素共振线的Nj / N0值
|
元素 |
共振线/nm |
Pj/P0 |
激发能/eV |
Nj/N0 |
||
|
2000K |
3000K |
5000K |
||||
|
Cs |
852.11 |
2 |
1.460 |
4.44×10-4 |
7.42×10-3 |
6.82×10-2 |
|
Na |
589.00 |
2 |
2.104 |
9.86×10-6 |
5.83×10-4 |
1.51×10-2 |
|
Ca |
422.67 |
3 |
2.932 |
1.22×10-7 |
3.55×10-5 |
3.33×10-3 |
|
Zn |
213.86 |
3 |
5.759 |
7.45×10-15 |
5.50×10-10 |
4.32×10-4 |
由式(7.1)和表7.1可以看出,对同种元素,温度越高,Nj/N0值越大;温度一定时,电子跃迁的能级差越小的元素,形成的激发态原子就越多,Nj/N0值就越大。在原子吸收的测定条件下,Nj/N0值一般在10-3以下,即激发态原子数不足0.1%,因此可以把基态原子数N0看作是吸收光辐射的原子总数。如果待测元素的原子化效率保持不变,则在一定浓度范围内基态原子数N0即与试样中待测元素的含量c呈线性关系;即
N0 =K′c (7.2)
从以上讨论还可以看出,激发态原子数受温度的影响大,而基态原子数受温度影响小,所以原子吸收光谱法的准确度优于原子发射光谱分析法,基态原子数远大于激发态原子数,因此原子吸收光谱法的灵敏度高于原子发射光谱分析法。
原子吸收谱线是具有一定宽度、轮廓(形状)、占据一定频率(波长)范围的光谱线。由于其宽度很窄,一般难以看清其形状,习惯上称之为谱线。表示原子吸收线轮廊的特征量是吸收线的特征频率![]() 0(波长λ0)和宽度,特征频率
0(波长λ0)和宽度,特征频率![]() 0
(波长λ0)是指吸收系数极大值K0所对应的频率(波长)。吸收线的宽度是指吸收系数极大值一半K0/2处吸收线轮廊间的频率(波长)差,又称为半宽度,常以Δ
0
(波长λ0)是指吸收系数极大值K0所对应的频率(波长)。吸收线的宽度是指吸收系数极大值一半K0/2处吸收线轮廊间的频率(波长)差,又称为半宽度,常以Δ![]() (Δλ)表示。图7.1 为吸收系数Kv随频率
(Δλ)表示。图7.1 为吸收系数Kv随频率![]() 的变化情况,即原子吸收线的轮廓。
的变化情况,即原子吸收线的轮廓。
原子吸收线的宽度受多种因素影响,其中主要有以下几种。
1.自然宽度(natural width,ΔvN)
在无外界影响时,谱线的宽度称自然宽度。自然宽度与激发态原子的平均寿命有关,寿
命越长,谱线宽度越小,一般约为10-5nm。
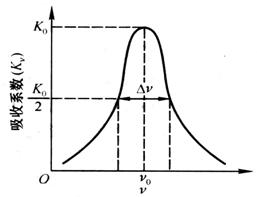
图7.1 原子吸收线的轮廓
2.多普勒变宽(Doppler broadening,ΔvD)
多普勒变宽是由原子不规则的热运动引起的,故又称为热变宽。在原子蒸气中,原子处于杂乱无章的热运动状态,当趋向光源方向运动时,原子将吸收频率较高的光波,当背离光源方向运动时,原子将吸收频率较低的光波,相对极大吸收频率而言,既有紫移(向高频方向移动),又有红移(向低频方向移动),这种现象称多普勒变宽或热变宽。其范围一般在1×10-3~5×10-3nm之间,影响其变宽的因素可用下式表示:
ΔvD= ![]()
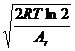 = 7.16×10-7
= 7.16×10-7![]() 0
0![]() (7.3)
(7.3)
式中,R为气体常数;Ar为吸光原子的相对原子质量;c 为光速;T为绝对温度;v0 为极大吸收频率。
上式表明,多普勒变宽与绝对温度的平方根成正比,与吸收质点的相对原子质量的平方根成反比。相对原子质量越小,温度越高,变宽程度就越大。
3.压力变宽(Pressure broadening)
吸收原子与外界气体分子之间的相互作用引起的变宽,称为压力变宽。它是由于碰撞使激发态寿命变短所致。压力变宽包括劳伦兹(Lorents)变宽![]() 和赫鲁兹马克
(Holtsmark ) 变宽
和赫鲁兹马克
(Holtsmark ) 变宽![]() 两种。前者指待测原子与其它粒子相互碰撞而产生的变宽;后者是指待测原子之间相互碰撞而产生的变宽,也称为共振变宽。共振变宽在待测元素浓度不很高时可忽略不计,这时,原子吸收谱线的变宽仅取决于劳伦兹变宽。影响其变宽因素可用下式表示:
两种。前者指待测原子与其它粒子相互碰撞而产生的变宽;后者是指待测原子之间相互碰撞而产生的变宽,也称为共振变宽。共振变宽在待测元素浓度不很高时可忽略不计,这时,原子吸收谱线的变宽仅取决于劳伦兹变宽。影响其变宽因素可用下式表示:
![]() =2NAσ2p
=2NAσ2p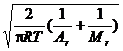 v0
(7.4)
v0
(7.4)
式中,NA为阿佛伽德罗常数(6.02×1023);σ为吸光原子与外来粒子间碰撞的有效截面积;p为外界气体压力;Ar为吸光原子的相对原子质量;Mr 为外界气体分子的相对分子质量。
由式(7.4)可以看出,劳伦兹变宽随外界气体压力、碰撞粒子的有效截面积的增加而增大;随温度、外界分子、吸光原子相对质量的增大而减小。在空心阴极灯内,气体的压强很低,劳伦兹变宽可以忽略不计,但在产生吸收的原子蒸气中,因为火焰中外来气体的压强较大,劳伦兹变宽不可忽略。
在通常原子吸收实验条件下,吸收线的轮廓主要受多普勒变宽和劳伦兹变宽影响。对火焰原子吸收,主要受劳伦兹变宽(ΔvL)影响;而对石墨炉原子吸收,主要受多普勒变宽(
ΔvD)影响,两者具有相同数量级,一般为10-3nm。
1.积分吸收
原子的发射线与吸收线本身都是具有一定宽度(频率)范围的谱线。要对其吸收进行准确测量,人们最初想到的就是求算吸收曲线所包含的整个吸收峰面积的方法,即求积分吸收![]() 的方法。
的方法。
积分吸收值可由下式表示:
![]() = aN0
(7.5)
= aN0
(7.5)
对于一定的元素,a为一常数。式(7.5)表明,积分吸收与单位体积原子蒸气中吸收辐射的基态原子数N0呈线性关系,而与频率无关,只要测得积分吸收即可求得N0,再根据N0与待测物中原子总数N以及待测物浓度c的关系,即可求出待测物的绝对含量,不需与标准比较。
而事实上,由于原子吸收谱线的宽度仅有10-3nm,要在这样狭窄的范围内准确测量积分吸收,一方面需要分辨率极高的单色器,制造这种单色器尚存在着技术上的困难;另一方面,即使制造出这种单色器,采用普通分光光度法所用的传统光源(氘灯、钨灯等连续光源),测定积分吸收也是行不通的。原因是原子吸收光谱法采用氘灯、钨灯等连续光源经单色器分光后,分出的是相对单色的光谱带。而在原子吸收光谱分析中,该辐射通过带有普通单色器的原子吸收分光光度计(狭缝最小可调至
2.峰值吸收
澳大利亚物理学家瓦尔西(Walsh A)于1955年提出了采用锐线光源作为辐射源测量谱线的称峰值吸收的新见解。吸收线中心波长处的吸收系数K0为峰值吸收系数,简称峰值吸收。
锐线光源就是能辐射出谱线宽度很窄的原子线光源,该光源的使用不仅可以避免采用分辨率极高的单色器,而且使吸收线和发射线变成了同类线,强度相近,吸收前后发射线的强度变化明显,测量能够准确进行。如图7.3所示。
为了使通过原子蒸气的发射线特征(极大)频率恰好能与吸收线的特征(极大)频率相一致,通常用待测元素的纯物质作为锐线光源的阴极,这样发射与吸收为同一物质,产生的发射线与吸收线特征频率完全相同,可以实现峰值吸收。
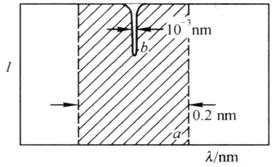
图7.2 连续光源(a)与原子吸收线(b)的通带宽度示意图
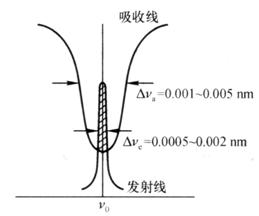
图7.3 峰值吸收测量示意图(阴影部分表示被吸收的发射线)
当频率为![]() ,强度为I0的平行光,通过厚度为L的基态原子蒸气时,基态原子对其产生吸收,使透射光I的强度减弱。根据比尔定律:
,强度为I0的平行光,通过厚度为L的基态原子蒸气时,基态原子对其产生吸收,使透射光I的强度减弱。根据比尔定律:
I = I0![]()
或 A= lg I0/ I = lg![]() = 0.4343Kv L
= 0.4343Kv L
当发射线的半宽度远小于吸收线的半宽度Δv发 <<Δv吸时,在积分界限内可以认为Kv为常数,并近似等于K0,此时
A= 0.4343 Kv L=0.4343K
峰值吸收系数K0与谱线的宽度有关,在通常原子吸收测量条件下,原子吸收线的轮廓仅取决于多普勒变宽ΔvD,此时有:
K0=
b![]()
![]() (7.7)
(7.7)
将式(7.5)代入式(7.7),变换后得:
K0= b![]() aN0
(7.8)
aN0
(7.8)
式中b为与谱线变宽过程有关的常数。
将式(7-8)代入(7-6)得:A= 0.4343 b a![]() N
N
将式(7-2)代入式(7-9)得:A= ![]() (7.10)
(7.10)
在具体测定中,式(7-10)前边各项均为定值,故
A = Kc (7.11)
由式(7.10)和式(7.11)可知,在特定条件下,吸光度A与待测元素的浓度c呈线性关系,A与多普勒变宽成反比,说明在原子吸收测量中,应尽量避免谱线变宽因子的影响,以保证测定具有较高的灵敏性和准确性。
7.3 原子吸收分光光度计
用于测量和记录待测物质在一定条件下形成的基态原子蒸气对其特征光谱线的吸收程度并进行分析测定的仪器,称为原子吸收光谱仪或原子吸收分光光度计。按原子化方式分,有火焰原子化和非火焰原子化两种;按入射光束分,有单光束和双光束型;按通道分,有单通道和多通道型。不论型号如何,其光源、原子化器、分光系统和检测系统这四大部件都是必不可少的。现以单光束火焰原子吸收分光光度计的基本结构为例(图7.4),讨论各部件的作用及测定原理。
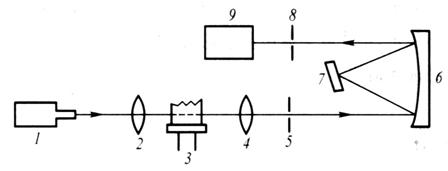
图7.4 单光束原子吸收分光光度计示意图
1.光源 2、4.透镜 3.(火焰)原子化器 5、8.入射与出射狭缝
6.凹面反射镜 7.光栅 9.检测系统
光源发射的待测元素的特征谱线,通过原子化器中待测元素的原子蒸气时,部分被吸收,透过部分经分光系统和检测系统即可测得该特征谱线被吸收的程度即吸光度。根据吸光度与浓度呈线性关系的原理,即可求出待测物的含量。
原子吸收光源的作用是发射待测元素的特征谱线,为了测定待测元素的峰值吸收,必须使用待测元素制成的锐线光源。通常对锐线光源的要求是:
(1)发射线的宽度要明显小于吸收线的半宽度,即Δve<<Δva。
(2)辐射应有足够的强度,以保证有足够高的信噪比。
(3)辐射应有足够的稳定性。
(4)光谱纯度要高,在光源通带内无其它干扰光谱。
能够符合上述条件的锐线光源主要有蒸气放电灯,无极放电灯和空心阴极灯。其中空心阴极灯锐线明晰,发光强度大,输出光谱稳定,结构简单,操作方便,获得广泛应用。
常用的空心阴极灯是由一个圆柱形空心阴极和一个棒状阳极组成的气体放电灯。空心阴极可由待测元素的金属或合金直接制作而成。阳极可用钨、钛、锆等纯金属制作,但最常用的是钨棒。阴极和阳极同时被封装在充有低压惰性气体的玻璃套管内,空心阴极腔应面对能透射辐射的石英窗口。这样放电的能量可集中在较小的面积上,使辐射强度更大。如图7.5所示。
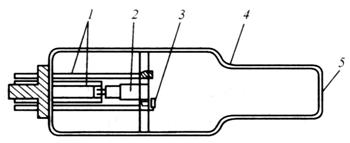
图7.5空心阴极灯示意图
1.电极支架 2.空心阴极 3.阳极 4.玻璃管 5.光窗
在放电管的两个极加足够高的电压( 300~500 V )时,电子将从空心阴极的内壁射向阳极,并在运动过程中与充入的惰性气体原子相互碰撞而使之电离,产生带正电荷的惰性气体离子。该正离子在电场作用下,高速射向阴极,使阴极表面金属原子溅射出来。溅射出来的金属原子再与电子、惰性气体原子及离子发生碰撞而被激发。处于激发态的粒子不稳定,很快就会返回基态,并以光的形式释放出多余的能量,产生待测元素的特征光谱线。
原子化器的作用是将试样中的待测元素转化为基态原子,以便对特征光谱线进行吸收。由于原子化器的性能将直接影响测定的灵敏度和测定的重现性,因此要求具备原子化效率高、噪音低、记忆效应小等特性。试样的原子化方法目前主要有火焰原子化、石墨炉原子化和低温原子化三类,这里主要介绍前两种。
1.火焰原子化器
火焰原子化器实际上是由雾化器和燃烧器两部分组成。燃烧器又可分为全消耗型和预混合型。前者原子化效率低,目前很少采用。后者由雾化器、预混室、燃烧器和供气系统四部分组成。结构如图7.6。
试样经喷雾器喷雾形成雾珠,较大的雾珠在预混合室内经撞击球撞击成较小的雾珠(约
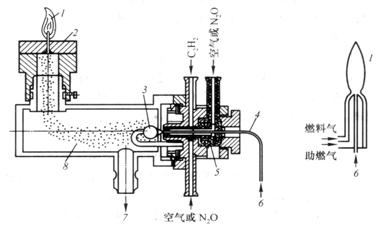
a. 预混合型 b. 全消耗型
图7.6火焰原子化器示意图
1.火焰 2.喷灯头3.撞击球4.毛细管
5.喷雾器6.试液进口
7.废液管 8.预混合室
试样中待测元素的原子化过程是一个复杂的理化过程,可大致示意如下。
M*(激发态原子)
![]()
MX(试液)![]() MX(气态)
MX(气态)![]() M0(基态原子)+ X0(气态)
M0(基态原子)+ X0(气态)
![]()
M+(离子)+ e-
火焰温度是影响原子化程度的重要因素。温度过高,会使试样原子激发或电离,基态原子数减少,吸光度下降。温度过低,不能使试样中盐类解离或解离率太小,测定的灵敏度也会受到影响,如果存在未解离分子的吸收,干扰就会更大。因此,必须根据实际情况,选择合适的火焰温度。常见的火焰及温度见表7.2。
表7.2 常用火焰的燃烧特性
|
燃气 |
助燃气 |
着火温度/K |
燃烧速率/cm·s-1 |
火焰温度/K |
|
乙炔 |
空气 |
623 |
158 |
2500 |
|
|
氧气 |
608 |
1140 |
3160 |
|
|
笑气(N2O) |
|
160 |
2990 |
|
氢气 |
空气 |
803 |
310 |
2318 |
|
|
氧气 |
723 |
1400 |
2933 |
|
|
笑气 |
|
390 |
2880 |
|
丙烷 |
空气 |
510 |
82 |
2198 |
|
|
氧气 |
490 |
|
3123 |
由表7.2可知,火焰的种类有多种,但最常用的是乙炔-空气火焰和乙炔-笑气火焰。前者最高温度约为2500K,适用于多数元素测定;后者最高温度2990K,适用于耐高温、难解离和激发电位较高的元素的原子化。
同种火焰又分为贫燃焰、富燃焰和化学计量焰三种类型。所谓化学计量焰(又称中性焰),是指助燃气与燃气按照它们的化学计量关系提供的,一般温度高,适用于多数元素原子化。燃气量大于化学计量的火焰称富燃焰。其颜色呈黄色,其特点是燃烧不完全,温度略低于化学计量焰,具有还原性,适用于易形成难解离氧化物的元素的测定。再就是它的干扰较多,背景高。助燃气大于化学计量的火焰称贫燃焰,其特点是颜色呈蓝色,氧化性较强,温度较低,适用于测定易解离、易电离的元素,如碱金属。
火焰原子化的优点是重现性好,操作简便,但不足之处是喷雾气体对试样的稀释严重,待测元素易受燃气和火焰周围空气的氧化生成难溶氧化物,使原子化效率降低,灵敏度下降。为克服火焰原子化的缺点,发展了石墨炉原子化器。
2.石墨炉原子化器
石墨炉原子化器与火焰原子化器的加热方式有本质的区别。前者是靠电加热,而后者则是靠火焰加热。石墨炉原子化器通常是用一个长约30~
测定时,试样用微量进样器注入石墨管,先通入小电流,在380K左右干燥试样,除去溶剂;再升温到400~1800K灰化试样,除去基体;然后升温到2300~3300K,将待测元素高温原子化,并记录吸光度值;最后升温到3300K以上,使管内遗留的待测元素挥发掉,消除其对下一试样产生的记忆效应,即清残。
石墨炉原子化器的原子化效率高,气相中基态原子浓度比火焰原子化器高数百倍,且基态原子在光路中的停留时间更长,因而灵敏度高得多,特别适用于低含量样品分析,取样量少,能直接分析液体和固体样品。但石墨炉原子化器操作条件不易控制,重现性、准确性均不如火焰原子化器,且设备复杂,费用较高。
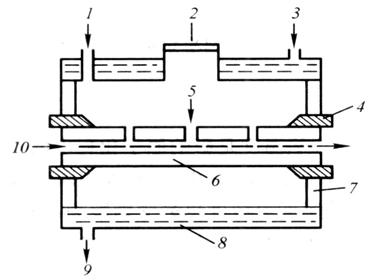
图7.7石墨炉原子化器示意图
1.保护气入口 2.进样窗
3、9.冷却水进出口4.电极
5.进样孔
6.石墨管 7.绝缘体 8.金属夹套 10.光路
3.低温原子化法
低温原子化技术包括氢化物发生法和冷原子化法。氢化物发生法,是利用某些待测元素易生成熔沸点均低于273K,且加热易分解的共价氢化物这一特性,用NaBH4等强还原剂将试样中待测元素还原为共价氢化物,接着用惰性气体导入电热石英管原子化器(或氩-氢火焰原子化器)中,在低于1200K的温度下进行原子化。氢化物发生法只限于Sn、As、Se、Sb、Ge、Pb等几个元素的分析。冷原子化法只限于汞的分析,其原理是在常温下用SnCl2等还原剂将无机汞化合物还原为气态汞原子,再由惰性气体导入石英管中测定,不必加热。
低温原子化技术本身就是一个分离富集过程,灵敏度比火焰原子化技术高得多,但精密度差些,且应用范围很有限。
分光系统的作用就是将待测元素的分析线与干扰线分开,使检测系统只接收分析线。它主要由入射狭缝、反射镜、色散元件(光栅、棱镜等)和出射狭缝等组成(如图7.4 的5~8部分)。光源发出的特征光经第一透镜聚集在待测原子蒸气时,部分被基态原子吸收,透过部分经第二透镜聚集在单色器的入射狭缝,经反射镜反射到单色器上进行色散后,再经出射狭缝,反射到检测器上。
分光系统的分辨能力取决于色散元件的色散率和狭缝宽度。对光栅而言,色散本领常用线色散率的倒数表示,即D= dλ/dL。其含义是在单色器焦面上每毫米距离内所含的波长(nm)数 (单位为nm·mm-1)。此值愈小,色散率愈大。狭缝的宽度与色散率倒数的乘积称为单色器的光谱通带宽度W,即通过单色器出射狭缝的光束的波长宽度(光电倍增管所接受到的光的波长范围)。其数学表达式为:
W = D · S (7.12)
式中,W为单色器通带宽度(单位为nm);S为狭缝宽度(单位为mm)。
每台仪器色散元件的色散率是固定的。故分辨能力仅与仪器的狭缝宽度有关。减小狭缝宽度,可提高分辨能力,有利于消除干扰谱线。但狭缝宽度太小,会导致透过光强度减弱,分析灵敏度下降。一般狭缝宽度调节在0.01~2mm之间。
原子吸收检测系统是由光电转换器、放大器和显示器组成,它的作用就是把单色器分出的光信号转换为电信号,经放大器放大后以透光率或吸光度的形式显示出来。
1.光电转换器
原子吸收法中常用的光电转换器为光电倍增管。光电倍增管的结构和原理见第二章(
描述光电倍增管质量特性的指标主要有光谱灵敏度,暗电流和输出稳定性。用Ga-As作光敏材料的光电倍增管在较广的波长范围内均有较好的光谱灵敏度,应用较普遍。暗电流是没有光照射到光电阴极时光电倍增管输出的电流。暗电流愈小,噪声愈小,光电倍增管的质量愈高。
光电倍增管在使用时应尽量避免非信号光照射和长时间无间隙使用,并尽量不用过高的电压,以确保光电管的良好工作特性。
2.放大器与显示器
光源发出的特征光经原子化器和单色器后已经很弱,虽然通过光电倍增管放大,往往还不能满足测量要求,需要进一步放大才能在显示器上显示出来。原子吸收常用同步解调放大器。它既有放大的作用,又能滤掉火焰发射以及光电倍增管暗电流产生的无用直流信号,从而有效提高信噪比。较先进的原子吸收显示器一般同时具有数字打印和显示、浓度直读、自动校准和微机处理数据的功能。
1.狭缝宽度
狭缝宽度的确定一般是调节不同的狭缝宽度测量试液的吸光度。当狭缝增宽到一定程度时,由于其它谱线或非吸收光出现在光谱通带内,使吸光度减小,因此,不引起吸光度减小的最大狭缝宽度就是最合适的狭缝宽度。
2.分析线
原子吸收分析线的选择应从灵敏度高、干扰少两方面考虑,大多数分析线选用主共振线,因为主共振线具有激发能量低,测定灵敏度高等特点。如果某分析线附近有其它光谱干扰时,人们可以选用灵敏度稍低的谱线作分析线。
适宜的分析线可由以下实验方法确定。首先扫描空心阴极灯的发射光谱,了解有几条可供选择的谱线,然后喷入相应的溶液,观察这些谱线的吸收情况,选用吸光度最大的谱线为分析线。常用的分析线可查阅有关手册。
3.灯电流
空心阴极灯的发射特性依赖于工作电流。灯的工作电流过低,光输出稳定性差,强度弱;灯的工作电流过大,放电不稳定,谱线变宽严重,灵敏度下降,校正曲线弯曲,灯的寿命缩短,实际工作中,选择原则是在保证输出稳定和适当光强的条件下,尽量选用低的工作电流。
4.试样用量
根据朗伯比尔定律,原子吸收的吸光度大小与待测元素的原子浓度成正比。但进样量大到一定程度时,吸光度不但不会增加,反而会因溶剂的冷却效应和大粒子散射使吸收值下降,背景增大。因此合适的取样量应由实验确定,其具体方法是在合适的燃烧器高度下,调节毛细管出口的压力以改变进样速率,达到最大吸光度值的进样量即为合适的试样用量。
7.4 干扰及消除方法
物理干扰是指试样在转移,蒸发和原子化过程中,由于溶质或溶剂的物理化学性质改变而引起的干扰。如在火焰原子吸收光谱中,试样粘度和雾化气体压力的变化直接影响试样的提升量和基态原子的浓度;表面张力影响气溶胶雾滴的大小;溶剂的蒸气压不同影响溶剂的挥发和冷凝;吸样毛细管的直径、长度及浸入试液的深度,也将影响进样速率。大量基体元素对待测元素蒸发也有影响。
物理干扰的消除办法是配制与待测溶液组成相似的标准溶液或采用标准加入法,使试液与标准溶液的物理干扰相一致,从而达到抵消误差的作用。
化学干扰是指在溶液或原子化过程中待测元素与其它组分发生化学反应而使其原子化效率降低或升高而引起的干扰。它是原子吸收法的主要干扰。
某些物质在原子化前的雾化室内相互混合时,由于小环境发生了变化,常温常压下不发生化学反应的物质,此时往往会生成新的难溶解物质而使其原子化效率发生改变,有些元素易生成难熔氧化物,使其解离度下降,原子化效率降低。
产生化学干扰的原因较复杂,消除干扰最常用的措施是加入释放剂、保护剂。
1.加释放剂
在测定钙时,若试液中存在磷酸根,则钙易在高温下与磷酸根反应生成难解离的Ca2P2O7,加入释放剂LaCl3后,La3+与PO43-可生成更稳定的LaPO4,从而抑制了磷酸根对钙的干扰。使测定的灵敏度大大提高。其反应为:
2CaCl2 + 2H3PO4
= Ca2P2O7 + 4HCl + H2O
H3PO4 + LaCl3 = LaPO4 + 3HCl
2.加保护剂
保护剂(或配位剂)是能与待测元素形成稳定的但在原子化条件下又易于解离的化合物的试剂。例如,在测定钙时加入EDTA,可有效地防止磷酸根对钙测定的干扰。这是因为Ca与EDTA形成更稳定的Ca-EDTA配合物,而Ca-EDTA在火焰中很容易被原子化,既达到了消除干扰的目的,又实现了钙的测定。配位剂、特别是有机配位剂对消除化学干扰的有效性,主要是由于有机物在火焰中更易被破坏,从而使与配位剂结合的金属元素迅速释放并原子化 。
若采用上述办法仍不能消除化学干扰时,只好采用萃取、沉淀、离子交换等分离办法,提前将干扰或待测元素分离出去,然后再进行测定。
电离干扰是待测元素在形成自由原子后进一步失去电子,而使基态原子数减少,测定结果和灵敏度降低的现象。这种干扰在火焰温度高,待测元素电离电位低的情况下最容易发生。
为了避免和消除电离干扰,在实际测量中,常常加入一定量的比待测元素更易电离的其它元素(即消电离剂),以达到抑制电离的目的。如在测定钙时,常加入一定量的钾盐溶液(钾和钙的电离电位分别为4.34和6.11eV),由于溶液中存在大量的钾电离出的自由电子,使待测元素钙的电离被抑制。
光谱干扰主要来自光源和原子化器。原子吸收法要求光源发射的共振线要落在原子化器中待测元素的吸收线中,两者的最大吸收频率要完全一致。但由于吸收线要远比发射线宽,而能够发射特征辐射的元素很多,在光谱通带内,常常还会存在以下光谱干扰。
1.非共振线干扰
光源在发射待测元素多条特征谱线时,通常选用最灵敏的共振线作为分析线。若分析线附近有单色器不能分离掉的待测元素其它特征谱线,它们将会对测量产生干扰。这类情况常出现于谱线多的过渡元素。如镍的分析线(232.00nm)附近还有231.60nm等多条镍的特征谱线,这些谱线均能被镍原子吸收。由于其它非共振线的吸收系数均小于共振线吸收系数,从而导致吸光度降低,标准曲线弯曲。改善和消除这种干扰的办法是缩小狭缝宽度。
2.背景吸收
背景吸收包括分子吸收和光散射引起的干扰。
分子吸收是指试样在原子化过程中,生成某些气体分子、难解离的盐类、难熔氧化物、氢氧化物等对待测元素的特征谱线产生吸收而引起的干扰。例如在测定钡时,钙的存在会生成Ca(OH)2,它在530~560nm处有一个吸收带,干扰钡553.5nm测定。
光散射是指原子化过程中产生的固体微粒。光路通过时对光产生散射,使被散射的光偏离光路,不为检测器所检测,测得的吸光度偏高。
在石墨炉原子吸收中,由于原子化过程形成固体微粒和产生难解离分子的可能性比火焰原子化大,所以,光的散射和分子吸收更为严重。
背景吸收的消除常用空白校正、氘灯校正和塞曼效应校正等几种方法。
(1)空白校正法 配制一个与待测试样组成浓度相近的空白溶液,则这两种溶液的背景吸收大致相同,测得待测溶液的吸光度减去空白溶液的吸光度即为待测试液的真实吸光度。但此法要配制组成、浓度相近的空白溶液却不容易。
(2)氘灯校正法 此法是同时使用空心阴极灯和氘灯两个光源,让两灯发出的光辐射交替通过原子化器。空心阴极灯特征辐射通过原子化器时,产生的吸收为待测原子和背景两种组分总的吸收A总,氘灯发出的连续光源通过原子化器时,产生的吸收仅为背景吸收A背(待测原子的吸收可忽略),两者之差(A总-A背)即为待测元素的真实吸收。这种扣除,在现代仪器中可自动进行。这种方法只能在氘灯辐射较强的190~350nm范围使用,且两灯的辐射应严格重合。
(3)塞曼效应校正法 1986年塞曼(Zeeman)发现,把产生光谱的光源置于强磁场内时,在磁场的作用下,光源辐射的每条线便可分裂成几条偏振化的分线,这种现象称为塞曼效应并被应用在原子吸收测定中。当在光源上加上与光束方向垂直的磁场时,光源发射的待测元素特征谱线将分裂为 p 和s+、s-三条分线。p分线的偏振方向与磁场平行,波长不变;s+和s-的偏振方向与磁场垂直,且波长分别向长波和短波方向偏移,如图6-8所示。当光源的三条分线通过原子化器时,基态原子仅对p分线产生吸收,对s±分线无吸收;而背景对p、s±分线均有吸收。用旋转式检偏器把p、s±分线分开,用p分线吸收值减去σ±分线吸收值即为待测元素的真实吸收值。塞曼效应校正法是目前最为理想的背景校正法,许多较先进的原子吸收光谱仪都有该自动校正功能。

图7.8塞曼效应示意图
7.5 原子吸收光谱法的分析方法
1.校正曲线法
配制一系列标准溶液,在给定的实验条件下,分别测得其吸光度A,以A为纵坐标,待测元素相应的浓度c为横坐标,绘制A~ c校正曲线。在相同实验条件下,测出待测试样溶液的吸光度,在校正曲线上查出其浓度即可求出待测元素的含量。
标准曲线法的优点是大批量样品测定非常方便。但不足之处是对个别样品测定仍需配制标准系列,手续比较麻烦,特别是组成复杂样品的测定,标准样的组成难以与其相近,基体效应差别较大,测定的准确度欠佳。
2.标准加入法
将试样分成体积相同的若干份(一般为5份),除一份外,其余各份分别加入已知量的不同浓度的标准溶液,如c1、c2、c3、c4,稀释、定容到相同的体积后,分别测量其吸光度Ax、A1、A2、A3、A4。以加入待测元素的标准量为横坐标,测得相应的吸光度为纵坐标作图,可得一条直线。将此直线外推至横坐标相交处,此点与原点(0点)的距离即为稀释后试样中待测元素的浓度(见图7.9)。标准加入法的最大优点是可最大限度地消除基体影响,但不能消除背景吸收。对批量样品测定手续太繁,对成分复杂的少量样品测定和低含量成分分析,准确度较高。
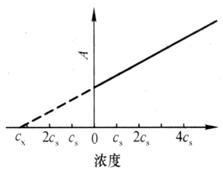
图7.9标准加入法工作曲线图
7.6 灵敏度与检出限
1.灵敏度
在原子吸收法中,灵敏度S可用下式表示:
Sc=![]() 或Sm =
或Sm =![]()
式中,Sc为浓度型检测器灵敏度;Sm为质量型检测器灵敏度。
由此可见,原子吸收法的灵敏度即是标准曲线的斜率,即待测元素的浓度(c)改变一个单位时吸光度(A)的变化量。斜率越大,灵敏度越高。
在火焰原子吸收法中,常用特征浓度cc这个概念来表征仪器对某一元素在一定条件下的分析灵敏度。所谓特征浓度(又称百分灵敏度)是指产生1%净吸收(即吸光度为0.0044)的待测元素浓度(单位为mg·(mL·1%)-1)
cc = ![]() =
= ![]()
在石墨炉原子吸收法中,常用特征质量mc(单位mg·(1%)-1)来表征分析灵敏度(又称绝对灵敏度)。所谓特征质量即产生1%净吸收(吸光度为0.0044)的待测元素质量。
mc = ![]() =
= ![]()
2.检出限
原子吸收法中检出限(D)以下式表示:
Dc = ![]() 或
或![]()
式中,s为用空白溶液进行10次以上吸光度测定所计算得到的标准偏差;Dc为火焰原子化法检出限(单位为 mg·mL-1);Dm为石墨炉原子化法(绝对)检出限(单位为g)。
7.7 原子吸收光谱法的应用
原子吸收光谱法广泛用于环保、材料、临床、医药、食品、冶金、地质、法医、交通和能源等多个方面。原子吸收法可对近80种元素进行直接测量,加上间接测量元素,总量可达百余种。在农、林、水、轻工等科学中,它主要用于土壤、动植物、食品、饲料、肥料、大气、水体等样品中金属元素和部分非金属元素的定量分析。
直接原子吸收分析,指试样经适当前处理后,直接测定其中的待测元素。金属元素和少数非金属元素可直接测定。
试样前处理后,含量较高的K、Na、Ca、Cu、Zn、Fe、Mn等元素可直接(或适当稀释后)用火焰原子化法测定;含量低的Cd、Ni、Co、Mo等元素需萃取富集后用火焰原子化法测定,或者直接用石墨炉原子化法测定;易挥发且含量低的Se、As、Sb等元素宜选用氢化物发生法或石墨炉原子化法;汞宜选冷原子化法或石墨炉原子化法。
间接原子吸收分析,指待测元素本身不能或不容易直接用原子吸收光谱法测定,而利用它与第二种元素(或化合物)发生化学反应,再测定产物或过量的反应物中第二种元素的含量,依据反应方程式即可算出试样中待测元素的含量。大部分非金属元素通常需要采用间接法测定。例如,试液中的氯与已知过量的AgNO3反应生成AgCl沉淀,用原子吸收法测定沉淀上部清液中过量的银,即可间接定量氯。此法曾用于尿、酒中5~10mg·mL-1氯的测定。利用BaCl2与SO42-的沉淀反应,间接定量SO42-,曾用于生物组织和土样中SO42-的测定。
有关原子吸收法在农林水科学,生理生化,环境监测、农副产品加工及食品检验中的具体应用,可参考相关的文献资料,有的已成为标准分析方法。表7.3列出了原子吸收法中部分元素的常用分析线。
表7.3 原子吸收法中部分元素的常用分析线
|
测定元素 分析线λ/nm |
测定元素 分析线λ/nm |
测定元素 分析线λ/nm |
|
Ag
328.07,338.29 Al
309.27,308.22 As
193.64,197.20 Au
242.80,267.60 B
249.68,249.77 Be
234.86 Bi
223.06,222.83 Ca
422.67,239.86 Cd
228.80,326.11 Co 240.71,242.49 Cr 357.87,359.35 |
Cs
852.11,455.54 Cu
324.75,327.40 Fe 248.33,352.29 Hg
253.65 K
766.49,769.90 Li
670.78,323.26 Mg
285.21,279.55 Mn
279.48,403.68 Mo
313.26,317.04 Na
589.00,330.30 Ni
232.00,341.48 |
Pb
216.70,283.31 Pt
265.95,306.47 Sb
217.58,206.83 Se
196.09,703.99 Si
251.61,250.69 Sn
224.61,286.33 Sr
460.73,407.77 W
255.14,294.74 Zn
213.86,307.59 |
例7.1 原子吸收分光光度法测定Ca
|
分析样品 |
自来水 |
|
分析项目 |
Ca |
|
分析方法 |
标准曲线法及标准加入法 |
|
分析条件 |
(1)火焰原子吸收分光光度计,燃助比1:3; (2)测定波长422.7 nm; (3)Ca空心阴极灯,灯电流4mA,光谱通带0.1nm。 |
|
分析结果 |
(1)绘制标准曲线,由未知试样的吸光度值求出自来水中Ca的含量。 (2)以标准加入法绘制工作曲线,将曲线外推至吸光度A=0,求出自来水中Ca含量。 |
例7.2 原子吸收分光光度法测定Zn
|
分析样品 |
(人和动物)毛发,土壤以及各类农林作物(如玉米、柑橘、油桐等) |
|
分析项目 |
Zn |
|
分析方法 |
标准曲线法 |
|
分析条件 |
(1)用湿消化法或干灰化法处理样品,制成试液; (2)火焰原子吸收分光光度计,燃助比1:4; (3)测定波长213.9 nm; (4)空心阴极灯,灯电流3mA,光谱通带0.2nm。 (由于型号各异,以上测定条件仅供参考。) |
|
分析结果 |
绘制标准曲线,由未知试样的吸光度值求出试样中Zn的含量。在备有计算机数据处理(软件)系统的原子吸收分光光度计,可据实验测得的吸光度A及输入相应的标准溶液浓度数据,即可绘出标准曲线。 |
例7.3 原子吸收分光光度法测定Cu
|
分析样品 |
水样 |
|
|
分析项目 |
Cu |
|
|
分析方法 |
标准曲线法(适用浓度范围0.05~5 mg·L-1) |
|
|
分析条件 |
|
(1)
火焰原子吸收分光光度计,乙炔-空气,氧化型 (2)
测定波长324.7nm (3)
空心阴极灯,灯电流3mA,光谱通带0.5nm |
|
分析结果 |
绘制标准曲线,根据未知样的吸光度值计算水样中铜的含量 |
|
7.8 原子荧光光谱法
原子荧光光谱法(Atomic Fluorescence
Spectrometry,AFS)是一种通过测量待测元素的原子蒸气在辐射能激发下所产生荧光的发射强度,进行定量分析的发射光谱分析方法。
原子荧光光谱法从机理看来属于发射光谱分析,但所用仪器及操作技术与原子吸收光谱法相近,故在本章讨论。
1. 原子荧光光谱的产生
气态自由原子吸收光源的特征辐射后,原子的外层电子跃迁到较高能级,然后又跃迁返回基态或较低能级,同时发射出与原激发辐射波长相同或不同的辐射即为原子荧光。原子荧光属光致发光,也是二次发光。当激发光源停止照射后,再发射过程立即停止。
2. 原子荧光的类型
原子荧光可分为共振荧光、非共振荧光与敏化荧光等三种类型。
(1)共振荧光 气态自由原子吸收共振线被激发后,再发射出与原激发辐射波长相同的辐射即为共振荧光,见图
(2)非共振荧光 当荧光与激发光的波长不相同时,产生非共振荧光。非共振荧光又分为直跃线荧光、阶跃线荧光和anti-Stokes荧光。
阶跃线荧光,见图7.10b,有两种情况,正常阶跃线荧光为被光照激发的原子,以非辐射形式去激发返回到较低能级,再以辐射形式返回基态而发射的荧光。其荧光波长大于激发线波长,例如钠原子吸收330.30nm的光,发射的荧光波长为589.00nm。热助阶跃线荧光为被光致激发的原子,跃迁至中间能级,又发生热激发至高能级,然后返回至低能级发射的荧光。例如铬原子被359.35nm的光激发后,会产生很强的387.87nm荧光。
直跃线荧光 激发态原子跃迁回至高于基态的亚稳态时所发射的荧光称为直跃线荧光,见图
(3)敏化荧光 受光激发的原子与另一种原子碰撞时,把激发能传递给另一个原子使其激发,后者在以辐射形式去激发而发射荧光即为敏化荧光。火焰原子化器中观察不到敏化荧光,在非火焰原子化器中才能观察到。
在以上各种类型的原子荧光中,共振荧光强度最大,最为常用。
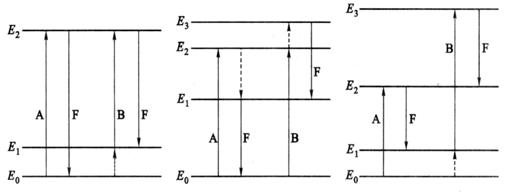
a
b
c
图7.10 原子荧光的主要类型示意图
a.共振荧光
b.阶跃线荧光
c.直跃线荧光
A.起始于基态
A.正常的
A.起始于基态
B.起始于亚稳态
B.热助的
B.起始于亚稳态
A、B.吸收 F.荧光 … .非辐射跃迁
3.荧光强度
共振荧光,荧光强度If正比于基态原子对某一频率激发光的吸收强度Ia。
If =
f Ia
式中f为荧光量子效率,它表示发射荧光光量子数与吸收激发光量子数之比。
若激发光源是稳定的,入射光是平行而均匀的光束,自吸可忽略不计,则基态原子对光吸收强度Ia用吸收定律表示
Ia = fAI0(1- e -εl N)
式中I0为原子化器内单位面积上接受的光源强度,A 为受光源照射在检测器系统中观察到的有效面积,l为吸收光程长,ε为峰值吸收系数,N为单位体积内的基态原子数。整理可得:
If = fA I0 ε l N
当仪器与操作条件一定时,除N外,其它为常数,N 与试样中被测元素浓度c成正比。
If = K c
上式为原子荧光定量分析的基础。
4.量子效率与荧光猝灭 受光激发的原子,可能发射共振荧光,也可能发射非共振荧光,还可能无辐射跃迁至低能级,所以量子效率一般小于1。
受激原子和其它粒子碰撞,把一部分能量变成热运动与其它形式的能量,因而发生无辐射的去激发过程,这种现象称为荧光猝灭。荧光猝灭会使荧光的量子效率降低,荧光强度减弱,从而降低测定灵敏度。实验证明,烃类火焰具有较强的猝灭作用,单原子惰性气体Ar,He的猝灭截面比N2,CO,CO2等原子化器中常见的气体要小得多,因此宜用以Ar作雾化气体的氢—氧火焰,或以He为保护气体(代替N2)的石墨炉原子化器。
原子荧光光度计分为非色散型和色散型。这两类仪器的结构基本相似,只是单色器不同。在原子荧光中,为了检测荧光信号,避免待测元素本身发射的谱线,要求光源、原子化器和检测器三者处于直角状态。而原子吸收光度计中,这三者是处于一条直线上。
原子荧光光度计与原子吸收光度计在很多组件上是相同的。如原子化器(火焰和石墨炉);用切光器及交流放大器来消除原子化器中直流发射信号的干扰;检测器为光电倍增管等。
1.激发光源
在原子荧光光度计中,需要采用高强度空心阴极灯、无极放电灯、激光和等离子体等。商品仪器中多采用高强度空心阴极灯、无极放电灯两种。
(1)高强度空心阴极灯 高强度空心阴极灯特点是在普通空极阴极灯中,加上一对辅助电极。辅助电极的作用是产生第二次放电,从而大大提高金属元素的共振线强度(对其它谱线的强度增加不大)。
(2)无极放电灯 无极放电灯比高强度空心阴极灯的亮度高,自吸小,寿命长。特别适用于在短波区内有共振线的易挥发元素的测定。
2.
原子化器
与原子吸收法相同。
3.色散系统
色散型的色散元件是光栅。非色散型用滤光器来分离分析线和邻近谱线,可降低背景。
4.检测系统
色散型原子荧光光度计用光电倍增管,非色散型的多采用日盲光电倍增管。
5.多元素原子荧光分析仪
原子荧光可由原子化器周围任何方向的激发光源激发而产生,因此设计了多道、多元素同时分析仪器。它也分为为非色散型和色散型。
1.定量分析方法
常用校准曲线法。
2.干扰及消除
原子荧光的主要干扰是猝灭效应。这种干扰可采用减少溶液中其它干扰离子的浓度避免。其它干扰因素如光谱干扰、化学干扰、物理干扰等与原子吸收光谱法相似。
在原子荧光法中由于光源的强度比荧光强度高几个数量级,因此散射光可产生较大的正干扰。减少散射干扰,主要是减少散射微粒。采用预混火焰、增高火焰观测高度和火焰温度,或使用高挥发性的溶剂等,均可以减少散射微粒。也可采用扣除散射光背景的方法消除其干扰。
3.氢化法在原子荧光中的应用
氢化法是原子荧光光度法中的重要分析方法,主要用于易形成氢化物的金属,如砷、碲、铋、硒、锑、锡、锗和铅等,汞生成汞蒸气。
氢化法是以强还原剂硼氢化钠(NaBH4)在酸性介质中与待测元素反应,生成气态的氢化物后,再引入原子化器中进行分析。
由于硼氢化钠在弱碱性溶液中易于保存,使用方便,反应速度快,且很容易地将待测元素转化为气体,所以在原子吸收和原子荧光光度法中得到广泛的应用。
(1)高灵敏度、低检出限特别对Cd、Zn等元素有相当低的检出限,Cd可达0.001ng.cm-3、Zn为0.04ng.cm-3。由于原子荧光的辐射强度与激发光源成比例,采用新的高强度光源可进一步降低其检出限。
(2)谱线简单、干扰少。
(3)分析校准曲线线性范围宽,可达3 ~ 5个数量级。
(4)多元素同时测定。
虽然原子荧光法有许多优点,但由于荧光猝灭效应,以致在测定复杂基体的试样及高含量样品时,尚有一定的困难。此外,散射光的干扰也是原子荧光分析中的一个麻烦问题。因此,原子荧光光谱法在应用方面不及原子吸收光谱法和原子发射光谱法广泛,但可作为这两种方法的补充。
思考题与习题
7.1影响原子吸收谱线宽度的因素有哪些?其中最主要的因素是什么?
7.2通常为什么不用原子吸收光谱法进行物质的定性分析?
7.3原子吸收光谱法,采用峰值吸收进行定量的条件和依据是什么?
7.4原子吸收光谱仪主要由哪几部分组成?各有何作用?
7.5使用空心阴极灯应注意什么?如何预防光电倍增管的疲劳?
7.6与火焰原子化相比,石墨炉原子化有哪些优缺点?
7.7光谱干扰有哪些,如何消除?
7.8简述原子吸收光谱法比原子发射光谱法灵敏度高,准确度高的原因?
7.9背景吸收是怎样产生的?对测定有何影响?如何扣除?
7.10比较标准加入法与校正曲线法的优缺点?
7.11原子吸收光谱仪三档狭缝调节,以光谱通带0.19
nm、0.38
nm和1.9
nm为标度,对应的狭缝宽度分别为
7.12测定植株中锌的含量时,将三份
7.13用原子吸收法测定钴获得如下数据:
|
ρ标/(mg·mL-1) |
2.00 |
4.00 |
5.00 |
8.00 |
10.0 |
|
T / % |
62.4 |
38.8 |
26.0 |
17.6 |
12.3 |
(1) 绘制A- c 校正曲线;
(2) 某一试液在同样条件下测得T=20.4%,求其试液中钴的质量浓度。
7.
7.试从原理、仪器、应用三方面对原子吸收、原子荧光光谱法进行比较。