第四章 红外吸收光谱法
Infrared Absorption Spectroscopy,IR
4.1 概述
红外吸收光谱法(infrared
absorption spectroscopy,IR)是利用物质分子对红外光的吸收及产生的红外吸收光谱来鉴别分子的组成和结构或定量的方法。当以连续波长的红外光为光源照射样品,引起分子振动能级之间跃迁,所生的分子振动光谱,称红外吸收光谱。在引起分子振动能级跃迁的同时不可避免的要引起分子转动能级之间的跃迁,故红外吸收光谱又称振-转光谱。
早在19世纪初人们通过实验证实了红外光的存在,二十世纪初人们进一步系统地了解了不同官能团具有不同红外吸收频率这一事实,1950年以后出现了自动记录式红外分光光度计。随着量子力学和计算机科学的迅速发展,1970年以后出现了傅立叶变换型红外光谱仪。红外测定技术如全反射红外、显微红外、光声光谱以及色谱-红外联用等也不断发展和完善,使红外光谱法得到广泛应用。
IR主要用于分子结构的基础研究以及化学组成的分析,其中应用最广泛的是中红外光区有机化合物的结构鉴定。由于每种化合物均有红外吸收,而且任何气态、液态、固态样品均可进行红外吸收光谱测定,因此红外光谱是有机化合物结构解析的重要手段之一。近年来,红外光谱的定量分析应用也有不少报导,主要是近红外和远红外光区的应用。如,近红外光区用于含有与C,H,O等原子相连基团化合物的定量;远红外光区用于无机化合物的定量等。本章主要讨论中红外吸收光谱法。
红外光谱在可见光区和微波光区之间,其波数范围约为12
800~
它处于可见光区到中红外光区之间。因为该光区的吸收带主要是由低能电子跃迁、含氢原子团(如O—H、N—H、C—H)伸缩振动的倍频及组合频吸收产生,摩尔吸收系数较低,检测限大约为0.1%。近红外辐射最重要的用途是对某些物质进行例行的定量分析。基于O—H伸缩振动的第一泛音吸收带出现在7
表4.1 红外光谱区的划分及主要应用
|
范围 |
波长范围 λ/μm |
波数范围
|
测定 类型 |
分析类型
试样类型 |
|
近红外 |
0.78~2.5 |
12800~4000 |
漫反射 吸收 |
定量分析 蛋白质、水分、淀粉、油、类脂、农产品中的纤维素等 定量分析 气体混合物 |
|
中红外 |
2.5~50 |
4000~200 |
吸收 反射 发射 |
定性分析 纯气体,液体或固体物质 定量分析 复杂的气体,液体或固体混合物 与色谱联用 复杂的气体,液体或固体混合物 定性分析 纯固体或液体混合物, 大气试样 |
|
远红外 |
50~1 000 |
200~10 |
吸收 |
定性分析 纯无机或金属有机化合物 |
绝大多数有机化合物和无机离子的基频吸收带出现在中红外光区。由于基频振动是红外光谱中吸收最强的振动,所以该区最适于进行定性分析。在20世纪80年代以后,随着红外光谱仪由光栅色散转变成干涉分光以来,明显地改善了红外光谱仪的信噪比和检测限,使中红外光谱的测定由基于吸收对有机物及生物质的定性分析及结构分析,逐渐开始通过吸收和发射中红外光谱对复杂试样进行定量分析。随着傅里叶变换技术的出现,该光谱区的应用也开始用于表面的显微分析,通过衰减全发射、漫反射以及光声测定法等对固体试样进行分析。由于中红外吸收光谱,特别是在4000
~
金属-有机键的吸收频率主要取决于金属原子和有机基团的类型。由于参与金属-配位体振动的原子质量比较大或由于振动力常数比较低,使金属原子与无机及有机配体之间的伸缩振动和弯曲振动的吸收出现在<
紫外、可见吸收光谱常用于研究不饱和有机化物,特别是具有共轭体系的有机化合物,而红外吸收光谱法主要研究在振动中伴随有偶极矩变化的化合物(没有偶极矩变化的振动在拉曼光谱中出现)。因此,除了单原子和同核分子如Ne、He、O2和H2等之外,几乎所有的有机化合物在红外光区均有吸收。除光学异构体,某些高分子量的高聚物以及在分子量上只有微小差异的化合物外,凡是具有结构不同的两个化合物,一定不会有相同的红外光谱。通常,红外吸收带的波长位置与吸收谱带的强度,反映了分子结构上的特点,可以用来鉴定未知物的结构组成或确定其化学基团;而吸收谱带的吸收强度与分子组成或其化学基团的含量有关,可用以进行定量分析和纯度鉴定。
由于红外光谱分析特征性强。对气体、液体、固体试样都可测定,并具有用量少,分析速度快,不破坏试样的特点,因此,红外光谱法不仅与其它许多分析方法一样,能进行定性和定量分析,而且该法是鉴定化合物和测定分子结构的最有用方法之一。一般来说,红外光谱法不太适用于水溶液及含水物质的分析,复杂化合物的红外光谱极其复杂,据此难以作出准确的结构判断,需要结合其他波谱进行判定。
红外吸收光谱图一般用T-![]() 曲线或以T-
曲线或以T-![]() 曲线表示。横坐标是波长
曲线表示。横坐标是波长![]() (μm)或波数
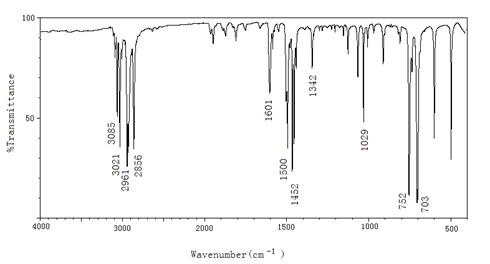
(μm)或波数![]() (cm-1), 纵坐标是百分透射比T%。如图4.1所示,为乙酰水杨酸(阿司匹林)的红外光谱图。
(cm-1), 纵坐标是百分透射比T%。如图4.1所示,为乙酰水杨酸(阿司匹林)的红外光谱图。
图4.1 乙酰水杨酸(阿司匹林)的红外光谱图
红外吸收光谱图与其紫外吸收曲线比较,红外吸收光谱曲线具有如下特点:第一,峰出现的频率范围低,横坐标一般用波长![]() (μm)或波数
(μm)或波数![]() (cm-1)表示,第二,吸收峰数目多,图形复杂;第三,吸收强度低。吸收峰出现的频率位置是由振动能级差决定,吸收峰的个数与分子振动自由度的数目有关,而吸收峰的强度则主要取决于振动过程中偶极矩的变化以及能级的跃迁概率。
(cm-1)表示,第二,吸收峰数目多,图形复杂;第三,吸收强度低。吸收峰出现的频率位置是由振动能级差决定,吸收峰的个数与分子振动自由度的数目有关,而吸收峰的强度则主要取决于振动过程中偶极矩的变化以及能级的跃迁概率。
4.2
基本原理
物质吸收红外光应满足两个条件,即:辐射光子具有的能量与发生振动跃迁所需的跃迁能量相等;辐射与物质之间有偶合作用。下面分别具体说明。
1.辐射光子具有的能量与发生振动跃迁所需的跃迁能量相等
红外吸收光谱是分子振动能级跃迁产生的。因为分子振动能级差为0.05 ~ 1.0eV,比转动能级差(0.0001 ~ 0.05eV)大,因此分子发生振动能级跃迁时,不可避免地伴随转动能级的跃迁,因而无法测得纯振动光谱。由量子力学可以证明,该分子的振动总能量(En)为:
E =(ν+1/2)h v
(4.1)
式中,v为振动频率;h为普朗克常数;ν为振动量子数,ν=0,1,2,3…。
在室温时,分子处于基态(n = 0),En=![]() h g ,此时,伸缩振动的频率很小。当有红外辐射照射到分子时,其吸收的红外辐射光子的能量(EL= h va)恰好等于分子振动能级的能量差(△Ev=
△n h v)时,则分子将吸收红外辐射而跃迁至激发态,导致振幅增大。分子振动能级的能量差为
h g ,此时,伸缩振动的频率很小。当有红外辐射照射到分子时,其吸收的红外辐射光子的能量(EL= h va)恰好等于分子振动能级的能量差(△Ev=
△n h v)时,则分子将吸收红外辐射而跃迁至激发态,导致振幅增大。分子振动能级的能量差为
va = 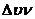 (4.2)
(4.2)
于是可得产生红外吸收光谱的第一条件为:
EL =△Ev
即
va =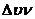
因此,只有当红外辐射频率等于振动量子数的差值与分子振动频率的乘积时,分子才能吸收红外辐射,产生红外吸收光谱。
分子吸收红外辐射后,由基态振动能级(n=0)跃迁至第一振动激发态(n=1)时,所产生的吸收峰称为基频峰,是强峰。在红外吸收光谱上除基频峰外,还有振动能级由基态
(ν0=0)跃迁至第二激发态(ν2=2)、第三激发态(ν3=3)…等所产生的吸收峰称为倍频峰。如以H—Cl为例:基频峰(ν0→ν1)
2.辐射与物质之间有耦合作用
为满足这个条件,分子振动必须伴随偶极矩的变化。红外跃迁是偶极矩诱导的,即能量转移的机制是通过振动过程所导致的偶极矩的变化和交变的电磁场(红外线)相互作用 发生的。
分子由于构成它的各原子的电负性的不同,也显示不同的极性,称为偶极子。通常用分子的偶极矩(m)来描述分子极性的大小。当偶极子处在电磁辐射电场时,该电场作周期性反转,偶极子将经受交替的作用力而使偶极矩增加或减少。由于偶极子具有一定的原有振动频率,显然,只有当辐射频率与偶极子频率相匹时,分子才与辐射相互作用(振动耦合)而增加它的振动能,使振幅增大,即分子由原来的基态振动跃迁到较高振动能级。因此,并非所有的振动都会产生红外吸收,只有发生偶极矩变化(△m≠0)的振动才能引起可观测的红外吸收光谱,该分子称之为红外活性的;△m=0的分子振动不能产生红外振动吸收,称为非红外活性的。
当一定频率的红外光照射分子时,如果分子中某个基团的振动频率和它一致,二者就会产生共振,此时光的能量通过分子偶极矩的变化而传递给分子,这个基团就吸收一定频率的红外光,产生振动跃迁。如果用连续改变频率的红外光照射某样品,由于试样对不同频率的红外光吸收程度不同,使通过试样后的红外光在一些波数范围减弱,在另一些波数范围内仍然较强,用仪器记录该试样的红外吸收光谱,进行样品的定性和定量分析。
原子与原子之间通过化学键连接组成分子。分子是有柔性的,因而可以发生振动。我们把不同原子组成的双原子分子的振动模拟为不同质量小球组成的谐振子振动,即把双原子分子的化学键看成是质量可以忽略不计的弹簧,把两个原子看成是各自在其平衡位置附近作伸缩振动的小球(见图4.2)。振动势能![]() 与原子间的距离
与原子间的距离![]() 及平衡距离
及平衡距离![]() 间关系:
间关系:
![]() (4.3)
(4.3)
式4.3中,![]() 为力常数,当
为力常数,当![]() 时,
时,![]() ,当
,当![]() 或
或![]() 时,
时,![]() 。振动过程位能的变化,可用势能曲线描述(见图4.3)。在A、B两原子距平衡位置最远时有:
。振动过程位能的变化,可用势能曲线描述(见图4.3)。在A、B两原子距平衡位置最远时有:
![]()
图4.2 双原子分子伸缩振动示意图
![]() .平衡位置原子间距离
.平衡位置原子间距离 ![]() .振动某瞬间原子间距离
.振动某瞬间原子间距离
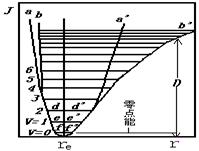
图4.3 双原子分子振动势能曲线
由图4.3的势能曲线可知:在常态下,处于较低振动能级的分子与谐振子振动模型极为相似。只有当![]() ≥3时,分子振动势能曲线才显著偏离谐振子势能曲线。
≥3时,分子振动势能曲线才显著偏离谐振子势能曲线。
![]() 2 双原子分子的振动
2 双原子分子的振动
如上所述,双原子分子运动可近似地看成一些用弹簧连接着的小球的运动。以经典力学的方法可把两个质量为m1和m2的原子看成钢体小球,连接两原子的化学键设想成无质量的弹簧,弹簧的长度r就是分子化学键的长度。则它们之间的伸缩振动可以近似的看成沿轴线方向的简谐振动。因此可以把双原子分子称为谐振子。由经典力学(虎克定律)可导出该体系的基本振动频率计算公式:
![]() (4.4)
(4.4)
![]() (4.5)
(4.5)
式中,c为光速,2.998×
对应的吸收谱带称为基频吸收峰,当![]() 的单位为cm-1,力常数的单位为N·cm-1,μ以折合相对原子质量Ar表示时,式(4.4)为,则上式可简化为
的单位为cm-1,力常数的单位为N·cm-1,μ以折合相对原子质量Ar表示时,式(4.4)为,则上式可简化为
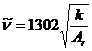 =1302
=1302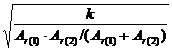 (4.6)
(4.6)
式中,Ar(1)、Ar(2) 分别为1、2两原子的相对原子质量。
由式4.6可知,双原子分子的振动频率取决于化学键的力常数和原子的质量,即取决于分子的结构特征。化学键越强,相对原子质量越小,振动频率越高,吸收峰将出现在高波数区。
同类原子组成的化学键(折合质量相同),力常数大的,基本振动频率就大;如,![]() CºC(
CºC(![]() C=C(
C=C(![]() C—C(
C—C(![]() C—C(
C—C(![]() C—N(
C—N(![]() C—O(
C—O(
例如,用式(4.6)计算的基频吸收峰的波数大于实测值。如H—Cl的k = 5.1 N·cm-1,由式(4.6)计算其基频吸收峰应为
多原子分子由于原子数目增多,组成分子的键或基团和空间结构不同,其振动光谱比双原子分子要复杂。但是可以把它们的振动分解成许多简单的基本振动,即简正振动。在红外光谱中分子的基本振动形式可分为两大类,一类是伸缩振动(v),另一类为弯曲振动(δ)。
1.简正振动
简正振动的振动状态是分子质心保持不变,整体不转动,每个原子都在其平衡位置附近做简谐振动,其振动频率和相位都相同,即每个原子都在同一瞬间通过其平衡位置,而且同时达到其最大位移值。分子中任何一个复杂振动都可以看成这些简正振动的线性组合。
2. 简正振动的基本形式
多原子分子的振动,不仅包括双原子分子沿其核-核(键轴方向)的伸缩振动,还有键角发生变化的的各种可能的变形振动。因此,一般将振动形式分为两类:即伸缩振动和变形振动。图4.4以亚甲基CH2为例,表示了多原子分子中各种振动形式。
(1) 伸缩振动 原子沿键轴方向伸缩,键长发生变化而键角不变的振动称为伸缩振动,用符号v表示。伸缩振动的力常数比弯曲振动的力常数要大,因而同一基团的伸缩振动常在高频区出现吸收。周围环境的改变对频率的变化影响较小。由于振动偶合作用,原子数n大于等于3的基团还可以分为对称伸缩振动和不对称伸缩振动符号分别为vs和vas一般vas比vs的频率高。

对称伸缩振动vs:
![]()
亚甲基的伸缩振动
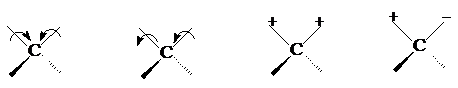
剪式振动δs:
![]()
![]()
面内弯曲振动
面外弯曲振动
![]()
亚甲基的弯曲振动
图4.4 亚甲基的基本振动形式
+、-分别表示运动方向垂直纸面向里和向外
(2) 弯曲振动 用δ表示,弯曲振动又叫变形或变角振动。一般是指基团键角发生周期性的变化的振动或分子中原子团对其余部分作相对运动。弯曲振动分为面内弯曲振动和面外弯曲振动。面内弯曲振动又分为剪式振动和面内摇摆;面外弯曲振动又分为面外摇摆和扭曲振动。弯曲振动的力常数比伸缩振动的小,因此同一基团的弯曲振动在其伸缩振动的低频区出现,另外弯曲振动对环境结构的改变可以在较广的波段范围内出现,所以一般不把它作为基团频率处理。
由于变形振动的力常数比伸缩振动小,因此,同一基团的变形振动都在其伸缩振动的低频端出现。变形振动对环境变化较为敏感。通常由于环境结构的改变,同一振动可以在较宽的波段范围内出现。
由于红外光谱中符号较多,为了便于学习和记忆,现将红外光谱中的常用符号列于表4.2中。
表4.2 红外光谱中常用符号
|
符 号 |
名 称 |
单 位 |
说 明 |
|
λ |
波长 |
μm |
|
|
|
波数 |
cm-1 |
|
|
ν |
1. 频率 |
秒-1 |
也可用cm-1表示 |
|
|
2. 伸缩振动符号 |
cm-1或秒-1 |
包括νs、νas |
|
νs |
对称伸缩振动 |
cm-1或秒-1 |
|
|
νas |
反称伸缩振动 |
cm-1或秒-1 |
|
|
δ |
弯曲振动 |
cm-1或秒-1 |
包括δs及ρ |
|
δs |
剪式振动 (面内弯曲振动) |
cm-1或秒-1 |
|
|
ρ |
面内摇摆振动 |
cm-1或秒-1 |
|
|
γ |
面外弯曲振动 |
cm-1或秒-1 |
包括ω及τ |
|
ω |
面外摇摆振动 |
cm-1或秒-1 |
|
|
τ |
面外扭曲振动 |
cm-1或秒-1 |
|
3.简正振动的理论数
多原子分子在红外光谱图上,可以出现一个以上的基频吸收带。基频吸收带的数目等于分子的振动自由度,而分子的总自由度又等于确定分子中各原子在空间的位置所需坐标的总数。很明显,在空间确定一个原子的位置,需要3个坐标(x、y和z)。当分子由n个原子组成时,则自由度(或坐标)的总数,应该等于平动、转动和振动自由度的总和,即
3n = 平动自由度 + 转动自由度 + 振动自由度
分子的质心可以沿x、y和z三个坐标方向平移,所以分子的平动自由度等于3,如图4.2所示。转动自由度是由原子围绕着一个通过其质心的轴转动引起的。只有原子在空间的位置发生改变的转动,才能形成一个自由度。不能用平动和转动计算的其它所有的自由度,就是振动自由度。这样
振动自由度 = 3 n -(平动自由度 + 转动自由度)
对于线性分子围绕x、y和z轴的转动,如果绕y和z轴转动,引起原子的位置改变,因此各形成一个转动自由度,分子绕x轴转动,原子的位置没有改变,不能形成转动自由度。这样,线性分子的振动自由度为3 n -(3+2)=3 n -5。非线性分子(如H2O)绕x、y和z轴转动,均改变了原子的位置,都能形成转动自由度。因此,非线性分子的振动自由度为3 n -6。理论上计算的一个振动自由度,在红外光谱上相应产生一个基频吸收带。例如,三个原子的非线性分子H2O,有3个振动自由度。红外光谱图中对应出现三个吸收峰,分别为3
(1)没有偶极矩变化的振动,不产生红外吸收,即非红外活性;
(2)相同频率的振动吸收重叠,简并为一个吸收峰。
(3)倍频峰和合频峰的产生。
(4)某些振动吸收强度太弱,或者某些振动吸收频率十分接近,仪器不能检测或不能分辨;某些振动吸收频率,超出了仪器的检测范围。
例如,线性分子CO2,理论上计算其基本振动数为:3 n -5=4。其具体振动形式如下:
|
← → O ═ C ═ O 对称伸缩(无吸收峰) |
→ ← → O ═ C ═ O 反对称伸缩( |
|
↑O ═ C ═ O↓ ↓ 面内变形( |
↖ ↖ O ═ C ═ O ↘ 面外变形( |
但在红外图谱上,只出现
振动能级的跃迁概率和振动过程中偶极矩的变化是影响谱峰强弱的两个主要因素。从基态向第一激发态跃迁时,跃迁概率大,因此,基频吸收带一般较强。从基态向第二激发态的跃迁,虽然偶极矩的变化较大,但能级的跃迁概率小,因此,相应的倍频吸收带较弱。应该指出,基频振动过程中偶极矩的变化越大,其对应的峰强度也越大。一般来说,极性基团(如O—H,C=O,N—H等)在振动时偶极矩变化较大,吸收峰较强;而非极性基团(如C—C,C=C等)的吸收峰较弱,在分子比较对称时,其吸收峰更弱。很明显,如果化学键两端连接的原子的电负性相差越大,或分子的对称性越差,伸缩振动时,其偶极矩的变化越大,产生的吸收峰也越强。例如,vC═O的强度大于vC═C的强度。因此,反对称伸缩振动的强度大于对称伸缩振动的强度,伸缩振动的强度大于变形振动的强度。
红外光谱的吸收强度一般定性地用很强(vs)、强(s)、中(m)、弱(w)和很弱(vw)等表示。按摩尔吸光系数e的大小划分吸收峰的强弱等级,具体如下:
ε >
4.3
基团频率和特征吸收峰
当分子吸收一定频率的红外线后,振动能级从基态(V0)跃迁到第一激发态(V1)时所产生的吸收峰,称为基频峰。
如果振动能级从基态(V0)跃迁到第二激发态(V2)、第三激发态(V3)….所产生的吸收峰称为倍频峰。通常基频峰强度比倍频峰强,由于分子的非谐振性质,倍频峰并非是基频峰的两倍,而是略小一些(H-Cl
分子基频峰是
多原子分子的红外光谱与其结构的关系,一般是通过实验手段得到的。这就是通过比较大量已知化合物的红外光谱,从中总结出各种基团的吸收规律来。实验表明,在有机物分子中,组成分子的各种基团,如O—H、N—H、C—H、C═C、C≡C、C═O等,都有自己特定的红外吸收区域,分子其它部分对其吸收位置影响较小。通常把这种能代表基团存在、并有较高强度的吸收谱带称为基团频率,一般是由基态跃迁到第一振动激发态产生的,其所在的位置一般又称为特征吸收峰。
基团的特征吸收峰可用于鉴定官能团。同一类型化学键的基团在不同化合物的红外光谱中吸收峰位置大致相同,这一特性提供了鉴定各种基团(官能团)是否存在的判断依据,从而成为红外光谱定性分析的基础。
在红外光谱中吸收峰的位置和强度取决于分子中各基团的振动形式和所处的化学环境。只要掌握了各种基团的振动频率及其位移规律,就可应用红外光谱来鉴定化合物中存在的基团及其在分子中的相对位置。常见的基团在波数4000~400 cm-1范围内都有各自的特征吸收,这个红外范围又是一般红外分光光度计的工作测定范围。在实际应用时,为了便于对红外光谱进行解析,通常将这个波数范围划分为以下几个重要的区段,参考此划分,可推测化合物的红外光谱吸收特征;或根据红外光谱特征,初步推测化合物中可能存在的基团。根据化学键的性质,结合波数与力常数、折合质量之间的关系,可将红外4000~
表4.3 光谱的八个重要区段
|
波 数(cm-1) |
波 长(μm) |
振 动 类 型 |
|
3750~3000 |
2.7~3.3 |
v(OH)、v (NH) |
|
3300~2900 |
3.0~3.4 |
v (≡C-H)>v (=C-H)≈v (Ar-H) |
|
3000~2700 |
3.3~3.7 |
v
(C-H)(-CH3、-CH2、≡C-H、 ) |
|
2400~2100 |
4.2~4.9 |
v (C≡C)、v (C≡N)、 |
|
1900~1650 |
5.3~6.1 |
v (C=O)(酸、醛、酮、胺、酯、酸、酐) |
|
1675~1500 |
5.9~6.2 |
v (C=C)、v (C=N) |
|
1475~1300 |
6.8~7.7 |
δ(CH) |
|
1000~650 |
10.0~15.4 |
|
按吸收的特征,中红外光谱可划分成
最有分析价值的基团频率在4000 cm -1 ~ 1300 cm -1 之间,这一区域称为基团频率区、官能团区或特征区。区内的峰是由伸缩振动产生的吸收带,比较稀疏,容易辨认,常用于鉴定官能团。
基团频率区可分为三个区域:
(1)4000 ~2500 cm -1为 X-H伸缩振动区,X可以是O、N、C或S等原子。
O-H基的伸缩振动出现在3650 ~3200 cm -1 范围内,它可以作为判断有无醇类、酚类和有机酸类的重要依据。当醇和酚溶于非极性溶剂(如CCl4),浓度于0.01mol·L-1时,在3650 ~3580 cm -1 处出现游离O-H基的伸缩振动吸收,峰形尖锐,且没有其它吸收峰干扰,易于识别。当试样浓度增加时,羟基化合物产生缔合现象,O-H基的伸缩振动吸收峰向低波数方向位移,在3400 ~3200 cm -1 出现一个宽而强的吸收峰。
胺和酰胺的N-H伸缩振动也出现在3500~3100 cm -1 ,因此,可能会对O-H伸缩振动有干扰。
C-H的伸缩振动可分为饱和和不饱和的两种。饱和的C-H伸缩振动出现在3000 cm -1以下,约3000~2800 cm -1 ,取代基对它们影响很小。如-CH3 基的伸缩吸收出现在2960 cm -1和2876 cm -1附近;R2CH2基的吸收在2930 cm -1 和2850 cm -1附近;R3CH基的吸收基出现在2890 cm -1 附近,但强度很弱。不饱和的C-H伸缩振动出现在3000 cm -1以上,以此来判别化合物中是否含有不饱和的C-H键。
苯环的C-H键伸缩振动出现在3030 cm -1附近,它的特征是强度比饱和的C-H浆键稍弱,但谱带比较尖锐。
不饱和的双键=C-H的吸收出现在3010~3040 cm -1范围内,末端= CH2的吸收出现在3085 cm -1附近。
叁键ºCH上的C-H伸缩振动出现在更高的区域(3300 cm -1 )附近。
(2)2500~1900 cm -1为叁键和累积双键区。
主要包括-CºC、-CºN等叁键的伸缩振动,以及-C =C=C、-C=C=O等累积双键的不对称性伸缩振动。
对于炔烃类化合物,可以分成R-CºCH和R¢-C ºC-R两种类型。R-CºCH的伸缩振动出现在2100~2140 cm -1附近;R¢-C ºC-R出现在2190~2260 cm -1附近;R-C ºC-R分子是对称,则为非红外活性。
-C ºN 基的伸缩振动在非共轭的情况下出现2240~2260 cm -1附近。当与不饱和键或芳香核共轭时,该峰位移到2220~2230 cm -1附近。若分子中含有C、H、N原子,-C ºN基吸收比较强而尖锐。若分子中含有O原子,且O原子离-C ºN基越近,-C ºN基的吸收越弱,甚至观察不到。
(3)1900~1200 cm -1为双键伸缩振动区。
该区域主要包括三种伸缩振动:
①C=O伸缩振动出现在1900~1650 cm -1 ,是红外光谱中 特征的且往往是最强的吸收,以此很容易判断酮类、醛类、酸类、酯类以及酸酐等有机化合物。酸酐的羰基吸收带由于振动耦合而呈现双峰。
②C=C伸缩振动。烯烃 的C=C伸缩振动出现在1680~1620 cm -1 ,一般很弱。单核芳烃的C=C伸缩振动出现在1600 cm -1和1500 cm -1附近,有两个峰,这是芳环的骨架结构,用于确认有无芳核的存在。
③苯的衍生物的泛频谱带,出现在2000~1650 cm -1范围, 是C-H面外和C=C面内变形振动的泛频吸收,虽然强度很弱,但它们的吸收面貌在表征芳核取代类型上有一定的作用。
在
(1)1
800~
(2)900~600
cm-1 这一区域的吸收峰是很有用的。例如,此区域的某些吸收峰可用来确认化合物的顺反构型。利用上区域中苯环的C-H面外变形振动吸收峰和2000~1667cm-1区域苯的倍频或组合频吸收峰,可以共同配合确定苯环的取代类型;又如,利用本区域中的某些吸收峰可以指示(—CH2—)n的存在。实验证明,当n≧4时,—CH2—的平面摇摆振动吸收出现在
在红外光谱中,每种红外活性的振动都相应产生一个吸收峰,所以情况十分复杂。例如,基团除在3700~
表4.4主要基团的红外特征吸收峰
|
基团 |
振 动 类 型 |
波 数 (cm-1) |
波 长 (μm) |
强度 |
备注 |
|
一、烷烃类 |
CH伸 |
3000~2800 |
3.33~3.57 |
中、强 |
分为反称与对称伸缩 |
|
|
CH弯(面内) |
1460~1350 |
6.70~7.41 |
中、弱 |
|
|
|
C—C伸(骨架振动) |
1250~1140 |
8.00~8.77 |
中 |
不特征 |
|
|
|
|
|
|
(CH3)—C及(CH3)2有 |
|
1.—CH3 |
CH伸(反称) |
2962±10 |
3.38±0.01 |
强 |
分裂为三个峰,此峰最有用 |
|
|
CH伸(对称) |
2872±10 |
3.48±0.01 |
强 |
共振时,分裂为二个峰,此为平均值 |
|
|
CH弯(反称,面内) |
1450±20 |
6.90±0.1 |
中 |
|
|
|
CH弯(对称,面内) |
1380~1370 |
7.25~7.30 |
强 |
|
|
2.—CH2— |
CH伸(反称) |
2926±10 |
3.42±0.01 |
强 |
|
|
|
CH伸(对称) |
2853±10 |
3.51±0.01 |
强 |
|
|
|
CH弯(面内) |
1465±10 |
6.83±0.1 |
中 |
|
|
|
CH伸 |
2890±10 |
3.46±0.01 |
弱 |
|
|
CH弯(面内) |
~1340 |
7.46 |
弱 |
|
|
|
4.—C(CH3)3 |
CH弯(面内) |
1395~1385 |
7.17~7.22 |
中 |
|
|
|
CH弯 |
1370~1365 |
7.30~7.33 |
强 |
|
|
|
C—C伸 |
1250±5 |
8.00±0.03 |
中 |
骨架振动 |
|
|
C—C伸 |
1250~1200 |
8.00~8.33 |
中 |
骨架振动 |
|
|
可能为CH弯(面外) |
~415 |
24.1 |
中 |
|
|
二、烯烃类 |
CH伸 |
3095~3000 |
3.23~3.33 |
中、弱 |
ν=C—H |
|
|
C=C伸 |
1695~1540 |
5.90~6.50 |
变 |
C=C=C则为2000~ |
|
|
*CH弯(面内) |
1430~1290 |
7.00~7.75 |
中 |
|
|
|
CH弯(面内) |
1010~667 |
9.90~15.0 |
强 |
中间有数段间隔 |
|
基团 |
振 动 类 型 |
波 数 (cm-1) |
波 长 (μm) |
强度 |
备注 |
|
(顺式) |
CH伸 |
3040~3010 |
3.29~3.32 |
中 |
|
|
CH弯(面内) |
1310~1295 |
7.63~7.72 |
中 |
|
|
|
CH弯(面外) |
770~665 |
12.99~15.04 |
强 |
|
|
|
(反式) |
CH伸 |
3040~3010 |
3.29~3.32 |
中 |
|
|
CH弯(面外) |
970~960 |
10.31~10.42 |
强 |
|
|
|
三、炔烃类 |
CH伸 |
~3300 |
~3.03 |
中 |
|
|
|
C≡C伸 |
2270~2100 |
4.41~4.76 |
中 |
由于此位置峰多,故无 应用价值 |
|
|
CH弯(面内) |
~1250 |
~8.00 |
|
|
|
|
CH弯(面外) |
645~615 |
15.50~16.25 |
强 |
|
|
1.R—C≡CH |
CH伸 |
3310~3300 |
3.02~3.03 |
中 |
有用 |
|
|
C=C伸 |
2140~2100 |
4.67~4.76 |
特弱 |
可能看不到 |
|
2.R—C≡C—R |
C≡C伸 |
2260~2190 |
4.43~4.57 |
|
|
|
|
①与C=C共轭 |
2270~2220 |
4.41~4.51 |
|
|
|
|
②与C=O共轭 |
~2250 |
~4.44 |
|
|
|
四、芳烃类 |
|
|
|
|
|
|
1.苯环 |
CH伸 |
3125~3030 |
3.20~3.30 |
变 |
一般三、四个峰 |
|
|
泛频峰 |
2000~1667 |
5.00~6.00 |
弱 |
苯环高度特征峰 |
|
|
骨架振动(νc=c) |
1650~1430 |
6.06~6.99 |
中、强 |
确定苯环存在最重要 峰之一 |
|
|
CH弯(面内) |
1250~1000 |
8.00~10.00 |
弱 |
|
|
|
CH弯(面外) |
910~665 |
10.99~15.03 |
强 |
确定取代位置最重要 吸收峰 |
|
|
苯环的骨架振动 (νc=c) |
1600±20 |
6.25±0.08 |
|
|
|
|
1500±25 |
6.67±0.10 |
|
|
|
|
|
|
1580±10 |
6.33±0.04 |
|
|
|
|
|
1450±20 |
6.90±0.10 |
|
共轭环 |
|
(1)单取代 |
CH弯(面外) |
770~730 |
12.99~13.70 |
极强 |
五个相邻氢 |
|
|
|
710~690 |
14.08~14.49 |
强 |
|
|
(2)邻双取代 |
CH弯(面外) |
770~735 |
12.99~13.61 |
极强 |
四个相邻氢 |
|
(3)间双取代 |
CH弯(面外) |
810~750 |
12.35~13.33 |
极强 |
三个相邻氢 |
|
|
|
725~680 |
13.79~14.71 |
中、强 |
三个相邻氢 |
|
|
|
900~860 |
11.12~11.63 |
中 |
一个氢(次要) |
|
(4)对双取代 |
CH弯(面外) |
860~790 |
11.63~12.66 |
极强 |
二个相邻氢 |
|
(5)1, 2, 3三取代 |
CH弯(面外) |
780~760 |
12.82~13.16 |
强 |
三个相邻氢与间双易 混,参考δCH及泛频峰 |
|
|
|
745~705 |
13.42~14.18 |
强 |
|
|
(6)1, 3, 5三取代 |
CH弯(面外) |
865~810 |
11.56~12.35 |
强 |
|
|
|
|
730~675 |
13.70~14.81 |
强 |
|
|
(7)1, 2, 4三取代 |
CH弯(面外) |
900~860 |
11.11~11.63 |
中 |
一个氢 |
|
|
|
860~800 |
11.63~12.50 |
强 |
二个相邻氢 |
|
*(8)1, 2, 3, 4四取代 |
CH弯(面外) |
860~800 |
11.63~12.50 |
强 |
二个相邻氢 |
|
*(9)1, 2, 4, 5四取代 |
CH弯(面外) |
870~855 |
11.49~11.70 |
强 |
一个氢 |
|
*(10)1, 2, 3, 5四取代 |
CH弯(面外) |
850~840 |
11.76~11.90 |
强 |
一个氢 |
|
*(11)五取代 |
CH弯(面外) |
900~860 |
11.11~11.63 |
强 |
一个氢 |
|
2.萘环 |
骨架振动(νc=c) |
1650~1600 |
6.06~6.25 |
|
|
|
|
|
1630~1575 |
6.14~6.35 |
|
相当于苯环的 |
|
|
|
1525~1450 |
6.56~6.90 |
|
|
|
五、醇类 |
OH伸 |
3700~3200 |
2.70~3.13 |
变 |
|
|
|
OH弯(面内) |
1110~1260 |
7.09~7.93 |
弱 |
|
|
|
C—O伸 |
1250~1000 |
8.00~10.00 |
强 |
|
|
|
O—H弯(面外) |
750~650 |
13.33~15.38 |
强 |
液态有此峰 |
|
(1) OH伸缩频率 |
|
|
|
|
|
|
游离OH |
OH伸 |
3650~3590 |
2.74~2.79 |
变 |
尖峰 |
|
分子间氢键 |
OH伸(单桥) |
3550~3450 |
2.82~2.90 |
变 |
|
|
分子间氢键 |
OH伸(多聚缔合) |
3400~3200 |
2.94~3.12 |
强 |
宽峰 |
|
分子内氢键 |
OH伸(单桥) |
3570~3450 |
2.80~2.90 |
变 |
|
|
分子内氢键 |
OH伸(螯形化物) |
3200~2500 |
3.12~4.00 |
弱 |
很宽 |
|
(2)OH弯或C-C伸 |
|
|
|
|
|
|
伯醇 |
OH弯(面内) |
1350~1260 |
7.41~7.93 |
强 |
|
|
—CH2OH |
C—O伸 |
~1050 |
~9.52 |
强 |
|
|
仲醇 |
OH弯(面内) |
1350~1260 |
7.41~7.93 |
强 |
|
|
|
C—O伸 |
~1110 |
~9.00 |
强 |
|
|
|
OH弯(面内) |
1410~1310 |
7.09~7.63 |
强 |
|
|
|
C—O伸 |
~1150 |
~8.70 |
强 |
|
|
六、酚类 |
OH伸 |
3705~3125 |
2.70~3.20 |
强 |
|
|
|
OH弯(面内) |
1390~1315 |
7.20~7.60 |
中 |
|
|
|
φ—O伸 |
1335~1165 |
7.50~8.60 |
强 |
φ—O伸即芳环上 νc=o |
|
七、醚类 |
|
|
|
|
|
|
1.脂肪醚 |
C—O伸 |
1210~1015 |
8.25~9.85 |
强 |
|
|
a. RCH2 –
O - CH2R |
C—O伸 |
~1110 |
~9.00 |
强 |
|
|
b. 不饱和醚 (H2O=CH-O)2 |
C=C伸 |
1640~1560 |
6.10~6.40 |
强 |
|
|
2.脂环醚 |
C—O伸 |
1250~909 |
8.00~11.0 |
中 |
|
|
a. 四元环 |
C—O伸 |
980~970 |
10.20~10.31 |
中 |
|
|
b. 五元环 |
C—O伸 |
1100~1075 |
9.09~9.30 |
中 |
|
|
c. 环氧化物 |
C—O伸 |
~1250 |
~8.00 |
强 |
|
|
|
|
~890 |
~11.24 |
|
反式 |
|
|
|
~830 |
~12.05 |
|
顺式 |
|
3.芳醚 |
Ar C—O伸 |
1270~1230 |
7.87~8.13 |
强 |
|
|
|
R—C—O—φ伸 |
1055~1000 |
9.50~10.00 |
中 |
|
|
|
CH伸 |
~2825 |
~3.53 |
弱 |
含—CH3的芳醚 (O—CH3) |
|
|
φ—O伸 |
1175~1110 |
8.50~9.00 |
中、强 |
在苯环上三或三以上取代时特别强 |
|
八、醛类 (—CHO) |
CH伸 |
2900~2700 |
3.45~3.70 |
弱 |
一般为两个谱带 ~ 及~ |
|
|
C=O伸 |
1755~1665 |
5.70~6.00 |
很强 |
|
|
|
CH弯(面外) |
975~780 |
10.26~12.80 |
中 |
|
|
1.饱和脂肪醛 |
C=O伸 |
1755~1695 |
5.70~5.90 |
强 |
CH伸、CH弯同上 |
|
|
其它振动 |
1440~1325 |
6.95~7.55 |
中 |
|
|
2.α,β-不饱和醛 |
C=O伸 |
1705~1680 |
5.86~5.95 |
强 |
CH伸、CH弯同上 |
|
3.芳醛 |
C=O伸 |
1725~1665 |
5.80~6.00 |
强 |
CH伸、CH弯向上 |
|
|
其它振动 |
1415~1350 |
7.07~7.41 |
中 |
与环上的取代基有关 |
|
|
其它振动 |
1320~1260 |
7.58~7.94 |
中 |
|
|
|
其它振动 |
1230~1160 |
8.13~8.62 |
中 |
|
|
|
C=O伸 |
1730~1540 |
5.78~6.49 |
极强 |
|
|
|
其它振动 |
1250~1030 |
8.00~9.70 |
弱 |
|
|
1.脂酮 |
泛频 |
3510~3390 |
2.85~2.95 |
很弱 |
|
|
(1)饱和链状铜 (-CH3-CO-CH2-) |
C=O伸 |
1725~1705 |
5.80~5.86 |
强 |
|
|
(2)α,β不饱和酮 (-CH=CH-CO-) |
C=O伸 |
1685~1665 |
5.94~6.01 |
强 |
由于C=O与C=C共 轭而降低 |
|
(3) α二酮 (-CO-CO-) |
C=O伸 |
1730~1710 |
5.78~5.85 |
强 |
|
|
(4)β二酮(希醇式) (-CO-CH2-CO-) |
C=O伸 |
1640~1540 |
6.10~6.49 |
强 |
宽、共轭螯合作用非 正常C=O峰 |
|
2.芳酮类 |
C=O伸 |
1700~1300 |
5.88~7.69 |
强 |
很宽的谱带可能是 νc=0与其它部分 振动的偶合 |
|
|
其它振动 |
1320~1200 |
7.57~8.33 |
|
|
|
(1) Ar—CO |
C=O伸 |
1700~1680 |
5.88~5.95 |
强 |
|
|
(2)二芳基酮 (Ar—CO—Ar) |
C=O伸 |
1670~1660 |
5.99~6.02 |
强 |
|
|
(3)1-酮基-2-羟基 或氨基芳酮 |
C=O伸 |
1665~1635 |
6.01~6.12 |
强 |
|
|
3.脂环酮 |
|
|
|
|
|
|
(1)六元、七元环酮 |
C=O伸 |
1725~1705 |
5.80~5.86 |
强 |
|
|
(2)五元环酮 |
C=O伸 |
1750~1740 |
5.71~5.75 |
强 |
|
|
十、羧酸类 (—COOH) |
|
|
|
|
|
|
1.脂肪酸 |
OH伸 |
3335~2500 |
3.00~4.00 |
中 |
二聚体, 宽 |
|
|
C=O伸 |
1740~1650 |
5.75~6.05 |
强 |
二聚体 |
|
|
OH弯(面内) |
1450~1410 |
6.90~7.10 |
弱 |
二聚体或1440~ |
|
|
C—O伸 |
1266~1205 |
7.90~8.30 |
中 |
二聚体 |
|
|
OH弯(面外) |
960~900 |
10.4~11.1 |
弱 |
|
|
(1)R—COOH |
C=O伸 |
1725~1700 |
5.80~5.88 |
强 |
|
|
(饱和) |
|
|
|
|
|
|
(2)α卤代脂肪酸 |
C=O伸 |
1740~1720 |
5.75~5.81 |
强 |
|
|
(3)α,β不饱和酸 |
C=O伸 |
1715~1690 |
5.83~5.91 |
强 |
|
|
2.芳酸 |
OH伸 |
3335~2500 |
3.00~4.00 |
弱、中 |
二聚体 |
|
|
C=O伸 |
1750~1680 |
5.70~5.95 |
强 |
二聚体 |
|
|
OH弯(面内) |
1450~1410 |
6.90~7.10 |
弱 |
|
|
|
C—O伸 |
1290~1205 |
7.75~8.30 |
中 |
|
|
|
OH弯(面外) |
950~870 |
10.5~11.5 |
弱 |
|
|
十一、酸酐 |
|
|
|
|
|
|
(1)链酸酐 |
C=O伸(反称) |
1850~1800 |
5.41~5.56 |
强 |
|
|
|
C=O伸(对称) |
1780~1740 |
5.62~5.75 |
强 |
|
|
|
C—O伸 |
1170~1050 |
8.55~9.52 |
强 |
|
|
(2)环酸酐 (五元环) |
C=O伸(反称) |
1870~1820 |
5.35~5.49 |
强 |
共轭时每个谱带降 |
|
|
C=O伸(对称) |
1800~1750 |
5.56~5.71 |
强 |
|
|
|
C—O伸 |
1300~1200 |
7.69~8.33 |
强 |
|
|
|
C=O伸(泛频) |
~3450 |
~2.90 |
弱 |
|
|
|
C=O伸 |
1820~1650 |
5.50~6.06 |
强 |
|
|
|
C—O—C伸 |
1300~1150 |
7.69~8.70 |
强 |
|
|
1,C=O伸缩振动 |
|
|
|
|
|
|
(1)正常饱酯类 |
C=O伸 |
1750~1735 |
5.71~5.76 |
强 |
|
|
(2)芳香酯及α,β 不饱和酯类 |
C=O伸 |
1730~1717 |
5.78~5.82 |
强 |
|
|
(3) β酮类的酯类 (烯醇型) |
C=O伸 |
~1650 |
~6.06 |
强 |
|
|
(4)δ-内酯 |
C=O伸 |
1750~1735 |
5.71~5.76 |
强 |
|
|
(5)γ-内酯(饱和) |
C=O伸 |
1780~1760 |
5.62~5.68 |
强 |
|
|
(6)β-内酯 |
C=O伸 |
~1820 |
~5.50 |
强 |
|
|
2.C—O伸缩振动 |
|
|
|
|
|
|
(1)甲酸酯类 |
C—O伸 |
1200~1180 |
8.33~8.48 |
强 |
|
|
(2)乙酸酯类 |
C—O伸 |
1250~1230 |
8.00~8.13 |
强 |
|
|
(3)酚类乙酸酯 |
C—O伸 |
~1250 |
~8.00 |
强 |
|
|
十三、胺 |
NH伸 |
3500~3300 |
2.86~3.03 |
中 |
|
|
|
NH弯(面内) |
1650~1550 |
6.06~6.45 |
|
伯胺强,中;伸胺极弱 |
|
|
C—N伸芳香 |
1360~1250 |
7.35~8.00 |
强 |
|
|
|
C—N伸脂肪 |
1235~1065 |
8.10~9.40 |
中、弱 |
|
|
|
NH弯(面外) |
900~650 |
11.1~15.4 |
|
|
|
(1)伯胺类 |
NH伸 |
3500~3300 |
2.86~3.03 |
中 |
两个峰 |
|
(C—NH2) |
NH弯(面内) |
1650~1590 |
6.06~6.29 |
强、中 |
|
|
|
C—N伸芳香 |
1340~1250 |
7.46~8.00 |
强 |
|
|
|
C—N伸脂肪 |
1220~1020 |
8.20~9.80 |
中、弱 |
|
|
(2)仲胺类 |
NH伸 |
3500~3300 |
2.86~3.03 |
中 |
一个峰 |
|
|
NH弯(面内) |
1650~1550 |
6.06~6.45 |
极弱 |
|
|
|
C—N伸芳香 |
1350~1280 |
7.41~7.81 |
强 |
|
|
|
C—N伸脂肪 |
1220~1020 |
8.20~9.80 |
中、弱 |
|
|
(3)叔胺 |
C—N芳香 |
1360~1310 |
7.35~7.63 |
强 |
|
|
|
C—N脂肪 |
1220~1020 |
8.20~9.80 |
中、弱 |
|
|
十四、不饱和含氮化合物 C≡N伸缩振动 |
|
|
|
|
|
|
(1)RCN |
C≡N伸 |
2260~2240 |
4.43~4.46 |
强 |
饱和,脂肪族 |
|
(2)α,β芳香氰 |
C≡N伸 |
2240~2220 |
4.46~4.51 |
强 |
|
|
(3)α,β不饱脂肪 族氰 |
C≡N伸 |
2235~2215 |
4.47~4.52 |
强 |
|
|
十五、杂环芳香族 化合物 |
|
|
|
|
|
|
|
CH伸 |
~3030 |
|
弱 |
吡啶与苯环类似 |
|
环的骨架振动 (νc=c及νc=x) |
1667~1430 |
6.00~7.00 |
中 |
两个峰~1615~1500 季铵移至 |
|
|
吡啶类 |
CH弯(面内) |
1175~1000 |
8.50~10.0 |
弱 |
|
|
(喹啉同吡啶) |
CH弯(面外) |
910~665 |
11.0~15.0 |
强 |
|
|
|
环上的CH面外弯 |
|
|
|
|
|
|
①普通取代基 |
|
|
|
|
|
|
α取代 |
780~740 |
12.82~13.51 |
强 |
|
|
|
β取代 |
805~780 |
12.42~12.82 |
强 |
|
|
|
γ取代 |
830~790 |
12.05~12.66 |
强 |
|
|
|
②吸电子基 |
|
|
|
|
|
|
α取代 |
810~770 |
12.35~13.00 |
强 |
|
|
|
β取代 |
820~800 |
12.20~12.50 |
强 |
|
|
|
|
730~690 |
13.70~14.49 |
强 |
|
|
|
γ取代 |
860~830 |
11.63~12.05 |
强 |
|
|
2.嘧啶类 |
CH伸 |
3060~3010 |
3.27~3.32 |
弱 |
|
|
|
环的骨架振动 (νc=c及 νc=x) |
1580~1520 |
6.33~6.58 |
中 |
|
|
|
环上的CH弯 |
1000~960 |
10.00~10.42 |
中 |
|
|
|
环上的CH弯 |
825~775 |
12.12~12.90 |
中 |
|
|
十六、硝基化合物 |
|
|
|
|
|
|
(1)R—NO2 |
NO2伸(反称) |
1565~1543 |
6.39~6.47 |
强 |
|
|
|
NO2伸(对称) |
1385~1360 |
7.22~7.35 |
强 |
|
|
|
C—N伸 |
920~800 |
10.87~12.50 |
中 |
用途不大 |
|
(2)Ar—NO2 |
NO2伸(反称) |
1550~1510 |
6.45~6.62 |
强 |
|
|
|
NO2伸(对称) |
1365~1335 |
7.33~7.49 |
强 |
|
|
|
CN伸 |
860~840 |
11.63~11.90 |
强 |
|
|
|
不明 |
~750 |
~13.33 |
强 |
|
注:“……”线以上为主要相关峰出现区间。线下为具体基团主要振动再现的具体区间。
“*”数据的可靠性差。
尽管基团频率主要由其原子的质量及原子的力常数所决定,但分子内部结构和外部环境的改变都会使其频率发生改变,因而使得许多具有同样基团的化合物在红外光谱图中出现在一个较大的频率范围内。为此,了解影响基团振动频率的因素,对于解析红外光谱和推断分子的结构是非常有用的。
影响基团频率的因素可分为内部及外部两类。
1.电子效应
(1)诱导效应(I效应) 由于取代基具有不同的电负性,通过静电诱导效应,引起分子中电子分布的变化,改变了键的力常数,使键或基团的特征频率发生位移。例如,当有电负性较强的元素与羰基上的碳原子相连时,由于诱导效应,就会发生氧上的电子转移:导致C═O键的力常数变大,因而使的吸收向高波数方向移动。元素的电负性越强,诱导效应越强,吸收峰向高波数移动的程度越显著,如表4.5所示。
表4.5 元素的电负性对νC═O的影响
|
R—CO—X |
X=R‘ |
X=H |
X=Cl |
X=F |
R=F,X=F |
|
νC═O/ cm-1 |
1 715 |
1 730 |
1 800 |
1 920 |
1 928 |
(2)共轭效应(C效应) 分子中形成大π键所引起的效应叫共轭效应。共轭效应的结果使共轭体系中的电子云密度平均化,例如1,3 –丁二烯的4个C原子都在一个平面上,4个C原子共有全部π电子,结果中间的单键具有一定的双键性质,而两个双键的性质有所削弱,由于共轭作用使原来的双键略有伸长,力常数减少,所以振动频率降低。
(3) 中介效应(M效应) 当含有孤对电子的原子(O、S、N等)与具有多重键的原子相连时,也可起类似的共轭作用,称为中介效应。在化合物中,C═O伸缩振动产生的吸收峰在
(4)空间效应 主要包括空间位阻效应和环状化合物的环张力效应等。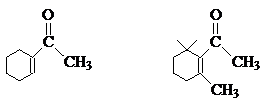 取代基的空间位阻效应将使得C=O与双键的共轭受到限制,使C=O双键性增加,波数升高。如:
取代基的空间位阻效应将使得C=O与双键的共轭受到限制,使C=O双键性增加,波数升高。如:
A
B
νC═O
B结构中由于立体障碍比较大,使环上双键和C=O不能处于同一平面,结果共轭受到限制,因此它的红外吸收波数比A高。同理可以解释下列化合物的光谱数据:
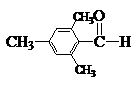
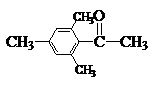
νC═O
环张力(键角张力作用)效应是指对于环外双键、环上羰基,随着环的张力增加,其波数也相应增加。
![]() 环酮类若以六元环为准,则六元环为准,则六元环至四元环每减少一元,波数增加
环酮类若以六元环为准,则六元环为准,则六元环至四元环每减少一元,波数增加
![]()
νC═O
环状的酸酐、内酰胺及内脂类化合物中,随着环的张力增加,νC=O吸收峰向高波数方向移动。带有张力的桥环羰基化合物,波数比较大,
环外双键的环烯,对于六元环烯来说,其νC=C吸收位置和R1R

νC=C
νC-H
如果双键碳原子上的氢原子被烷基取代,则νC=C 将向高波数移动。
2.氢键效应
氢键使参与形成氢键的原化学键力常数降低,吸收频率移向低波数方向,但同时振动偶极矩的变化加大,因而吸收强度增加。氢键的形成,往往对吸收峰的位置和强度都有极明显的影响。这是因为质子给出基X-H与质子接受基Y形成了氢键:X-H、、、Y,其X、Y通常是N、O、F等电负性大的原子。这种作用使电子云密度平均化,从而使键的力常数减少,频率下降。氢键分为分子内氢键和分子间氢键。
(1)分子内氢键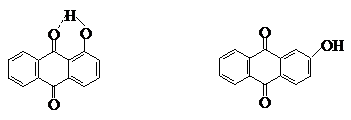 分子内氢键的形成,可使谱带大幅度地向低波数方向位移。例如OH与C=O基形成分子内氢键,νC=O及νO-H吸收都向低波数移动。例如:
分子内氢键的形成,可使谱带大幅度地向低波数方向位移。例如OH与C=O基形成分子内氢键,νC=O及νO-H吸收都向低波数移动。例如:
形成分子内氢键
未形成分子间氢键
νC=O (缔合)
νO-H (缔合)
β-二酮或β-羰基酸酯,因为分子内部发生互变异构,分子内形成氢键吸收峰也将发生
 位移。在IR光谱上能够出现各种异构体的峰带,例如:
位移。在IR光谱上能够出现各种异构体的峰带,例如:
酮式
烯醇式
νC=O
(2)分子间氢键 醇和酚的OH基,在极稀的溶液中呈游离态,分子在3650~3500 cm-1出现吸收峰,随着浓度的增加,分子间形成氢键,故νO-H吸收峰向低波数方向位移。图4.5是不同浓度的乙醇在CCl4溶液中的IR光谱。当乙醇溶液的浓度为1
mol·L-1时,乙醇分子以多聚体的形式存在(分子间缔合),νO-H(缔合)移到
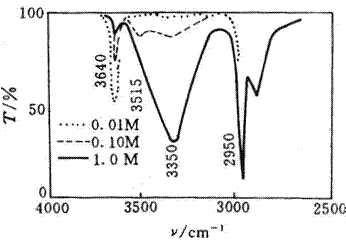
图4.5是不同浓度的乙醇在CCl4溶液中的IR光谱
分子内氢键不随溶液浓度的改变而改变,因此,其特征频率也基本保持不变。如邻硝基苯酚在浓溶液或在稀溶液中测定时νO-H吸收峰在
3.振动偶合效应
当两个振动频率相同或相近的基团相邻具有一公共原子时,由于一个键的振动通过公共原子使另一个键的长度发生改变,产生一个“微扰”,从而形成了强烈的振动相互作用。其结果是使振动频率发生变化,一个向高频移动,另一个向低频移动,谱带分裂,这种相互作用称为振动偶合。。振动耦合常出现在一些二羰基化合物中,如,羧酸酐中,两个羰基的振动耦合,使nC=O吸收峰分裂成两个峰,波数分别为

νas(C=O)~
4.费米(Fermi)共振效应
当一振动的倍频(或组频)与另一振动的基频吸收峰接近时,由于发生相互作用而产生很强的吸收峰或发生裂分,这种倍频(或组频)与基频峰之间的振动偶合称费米共振。
苯甲酰氯的νC=O 为
外部因素主要指测定物质的状态、溶剂效应及仪器色散元件的影响。
1.样品物理状态的影响
同一物质的不同状态,由于分子间相互作用力不同,所得到光谱往往不同。所以在查阅标准谱图时,要注意试样状态及制样方法。在气态时,分子间的相互作用很小,在低压下能得到游离分子的吸收峰,此时可以观察到伴随振动光谱的转动精细结构。在液态时,由于分子间出现缔合或分子内氢键的存在,IR光谱与气态和固态情况不同,峰的位置与强度都会发生变化。在固态时,因晶格力场的作用,发生了分子振动与晶格振动的偶合,将出现某些新的吸收峰。其吸收峰比液态和气态时尖锐且数目增加,例如,丙酮νC=O在气态时为
2.溶剂的影响
在溶液中测定光谱时,由于溶剂的种类、溶剂的浓度和测定时的温度不同,同一种物质所测得的光谱也不同。通常在极性溶剂中,溶质分子的极性基团的伸缩振动频率随溶剂极性的增加而向低波数方向移动,并且强度增大。因此,在红外光谱测定中,应尽量采用非极性的溶剂。例如,羧酸νC=O在不同溶剂中的波数变化如下:
3. 仪器色散元件的影响
红外分光光度计中使用的色散元件主要为棱镜和光栅两类,棱镜的分辨率低,光栅的分辨率高,特别在4000~2500波段内尤为明显。
4.4 红外光谱仪器
测定红外吸收的仪器有三种类型:①光栅色散型分光光度计,主要用于定性分析;②傅里叶变换红外光谱仪,适宜进行定性和定量分析测定;③非色散型光度计,用来定量测定大气中各种有机物质。
在20世纪80年代以前,广泛应用光栅色散型红外分光光度计。随着傅里叶变换技术引入红外光谱仪,使其具有分析速度快、分辨率高、灵敏度高以及很好的波长精度等优点。但因它的价格、仪器的体积及常常需要进行机械调节等问题而在应用上受到一定程度的限制。近年来,因傅里叶变换光谱仪器体积的减小,操作稳定、易行,一台简易傅里叶红外光谱仪的价格与一般色散型的红外光谱仪相当。由于上述种种原因,目前傅里叶红外光谱仪已在很大程度上取代了色散型。
色散型红外分光光度计和紫外、可见分光光度计相似,也是由光源、单色器、试样室、检测器和记录仪等组成。由于红外光谱非常复杂,大多数色散型红外分光光度计一般都是采用双光束,这样可以消除CO2和H2O等大气气体引起的背景吸收。其结构如图4.6所示。自光源发出的光对称的分为两束,一束为试样光束,透过试样池;另一束为参比光束,透过参比池后通过减光器。两光束再经半圆扇形镜调制后进入单色器,交替落到检测器上。在光学零位系统里,只要两光的强度不等,就会在检测器上产生与光强差呈正比的交流信号电压。由于红外光源的低强度以及红外检测器的低灵敏度,以至需要用信号放大器。
一般来说,色散型红外分光光度计的光学设计与双光束紫外、可见分光光度计没有很大的区别。除对每一个组成部分来说,它的结构,所用材料及性能等与紫外及可见光度计不同外,它们最基本的一个区别是:前者的参照和试样室总是放在光源和单色器之间,后者则是放在单色器的后面。试样被置于单色器之前,一来是因为红外辐射没有足够的能量引起试样的光化学分解,二来是可使抵达检测器的杂散辐射量(来自试样和吸收池)减至最小。
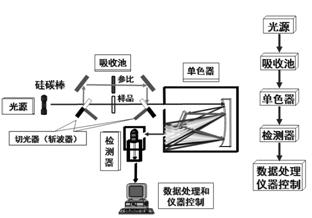
图4.6色散型红外吸收光谱仪的基本组成
1.光源
红外光谱仪中所用的光源通常是一种惰性固体,用电加热使之发射高强度的连续红外辐射。目前在中红外区较实用的红外光源主要有硅碳棒和能斯特灯。
硅碳棒由碳化硅烧结而成。其辐射强度分布偏向长波,工作温度一般为1 300~1 500K。因为碳化硅有升华现象,使用温度过高将缩短碳化硅的寿命,并会污染附近的染色镜。硅碳棒发光面积大,价格便宜,操作方便,使用波长范围较能斯特灯宽。
能斯特灯主要由混合的稀土金属(锆、钍、铈)氧化物制成。它有负的电阻温度系数,在室温下为非导体,当温度升高到大约
在λ>50μm的远红外光区,需要采用高压汞灯。在20
000~8
2.吸收池
红外光谱仪能测定固、液、气态样品。气体样品一般注入抽成真空的气体吸收池进行测定;液体样品可滴在可拆池两窗之间形成薄的液膜进行测定;溶液样品一般注入液体吸收池中进行测定;固体样品最常用压片法进行测定。因玻璃、石英等材料不能透过红外光,红外吸收池要用可透过红外光的NaCl、KBr、CsI、KRS-5(TlI 58%,TlBr 42%)等材料制成窗片。用NaCl、KBr、CsI等材料制成的窗片需注意防潮。固体试样常与纯KBr混匀压片,通常用300mg光谱纯的KBr粉末与1~3mg固体样品共同研磨混匀后,压制成约
用于测定红外光谱的样品需要有较高的纯度(>98%)才能获得准确的结果。此外,红外测定的样品池都是以KBr或NaCl为透光材料,它们极易吸水而被破坏,所以样品中不应含有水份。
3 .单色器
单色器由色散元件、准直镜和狭缝构成。它是红外分光光度计的心脏,其作用是把进入狭缝的复合光色散为单色光。色散元件常用复制的闪耀光栅。由于闪耀光栅存在次级光谱的干扰,因此,需要将光栅和用来分离次光谱的滤光器或前置棱镜结合起来使用。
4.检测器
检测器的作用是将经色散的红外光谱的各条谱线强度转变成电信号。常用的红外检测器有高真空热电偶、热释电检测器和碲镉汞检测器。
红外光区的检测器一般有两种类型,热检测器和光导电检测器。红外光谱仪中常用的热检测器有:热电偶、测辐射热计、气体(Golay)检测器和热电检测器等。热电偶和辐射热测量计主要用于色散型分光光度计中,而热电检测器主要用于中红外傅里叶变换光谱仪中,这种检测器利用某些热电材料的晶体,如硫酸三甘氨酸酯(TGS)等,将其晶体放在两块金属板中,当红外光照射到晶体上时,晶体表面电荷分布发生变化,由此可以测量红外辐射的强度。光检测器多采用硒化铅(PbSe)等,当受光照射后导电性能变化从而产生信号。光检测器比热检测器灵敏几倍。他是由一层半导体薄膜,如硫化铅,汞/镉碲化物,或者锑化铟等沉积到玻璃表面组成,抽真空并密封以与大气隔绝。当这些半导体材料吸收辐射后,使某些价电子成为自由电子,从而降低了半导体的电阻。除硫化铅广泛应用于近红外光区外,在中红外和远红外光区主要采用汞/镉碲化物作为敏感元件,为了减小热噪音,必须用液氮冷却。在长波段的极限值和检测器的其它许多性质则取决于碲化汞/碲化镉的比值。汞/镉碲化物作为敏感元件的光电导检测器提供了优于热电检测器的响应特征,广泛应用于多通道傅里叶变化的红外光谱仪中,特别是在与气相色谱联用的仪器中。
5.记录系统
电信号经放大器放大后,由记录系统获得红外吸收光谱图。
色散型红外吸收光谱仪是扫描式的仪器,扫描需要一定的时间,完成一幅红外光谱的扫描需10min。所以色散型红外光谱仪不能测定瞬间光谱的变化,也不能实现与色谱仪的联用。此外,色散型红外光谱仪分辨率较低,要获得0.1~0
傅里叶变换红外光谱仪(fourier transform infrared spectrometer,FTIR)是20世纪70年代问世的,被称为第三代红外光谱仪。
傅里叶变换红外光谱仪是由红外光源、干涉仪、试样插入装置、检测器、计算机和记录仪等部分构成。图4.7是Digilab FTS-14型傅里叶变换红外光谱仪的光路示意图。其光源为硅碳棒和高压汞灯,与色散型红外分光光度计所用的光源是相同的;检测器为TGS和PbSe;干涉仪采用迈克逊(Michelson)干涉仪,按其动镜移动速度不同,可分为快扫描和慢扫描型。慢扫描型迈克尔逊干涉仪主要用于高分辨光谱的测定,一般的傅里叶红外光谱仪均采用快扫描型的迈克尔逊干涉仪。Michelson干涉仪是FTIR的核心部分,它将光源来的信号以干涉图的形式送往计算机进行Fourier变换的数学处理,最后将干涉图还原成光谱图;计算机的主要作用是:控制仪器操作;从检测器截取干涉谱数据;累加平均扫描信号;对干涉谱进行相位校正和傅里叶变换计算;处理光谱数据等。它与色散型红外光度计的主要区别在于干涉仪和电子计算机两部分。
1. Fourier变换红外光谱仪的工作原理
仪器中的Michelson干涉仪的作用是将光源发出的光分成两光束后,再以不同的光程差重新组合,发生干涉现象。当两束光的光程差为l/2的偶数倍时,则落在检测器上的相干光相互叠加,产生明线,其相干光强度有极大值;相反,当两束光的光程差为l/2的奇数倍时,则落在检测器上的相干光相互抵消,产生暗线,相干光强度有极小值。由于多色光的干涉图等于所有各单色光干涉图的加合,故得到的是具有中心极大,并向两边迅速衰减的对称干涉图。
干涉图包含光源的全部频率和与该频率相对应的强度信息,所以,如有一个有红外吸收的样品放在干涉仪的光路中,由于样品能吸收特征波数的能量,结果所得到的干涉图强度曲线就会相应地产生一些变化。包括每个频率强度信息的干涉图,可借数学上的Fourier变换技术对每个频率的光强进行计算,从而得到吸收强度或透过率和波数变化的普通光谱图。
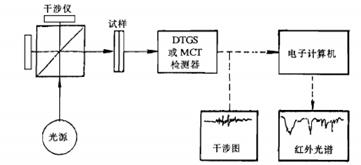
图4.7 傅里叶变换红外光谱仪工作原理示意图
2.傅里叶变换光谱仪的优点
(1)扫描速度极快 Fourier变换仪器是在整扫描时间内同时测定所有频率的信息,一般只要1s左右即可。因此,它可用于测定不稳定物质的红外光谱。而色散型红外光谱仪,在任何一瞬间只能观测一个很窄的频率范围,一次完整扫描通常需要8、15、30s等。傅里叶变换红外光谱仪在取得光谱信息上与色散型分光光度计不同的是采用干涉仪分光。在带狭缝的色散型分光度计以t时间检测一个光谱分辨单元的同时,干涉仪可以检测M个光谱分辨单元,显然后者在取得光谱信息的时间上比常规分光光度计节省(M-1)t,即记录速度加快了(M-1)倍,其扫描速度较色散型快数百倍。这样不仅有利于光谱的快速记录,而且还会改善信噪比。不过这种信噪比的改善是以检测器的噪音不随信号水平增高而同样增高为条件。红外检测器是符合这个要求的,而光电管和光电倍增管等紫外、可见光检测器则不符合这个要求,这使傅里叶变换技术难于用于紫外、可见光区。光谱的快速记录使傅里叶变换红外光谱仪特别适于与气相色谱、高效液相色谱仪联极使用,也可用来观测瞬时反应。
(2)具有很高的分辨率 通常Fourier变换红外光谱仪分辨率达0.1~
(3)灵敏度高 因Fourier变换红外光谱仪不用狭缝和单色器,反射镜面又大,故能量损失小,到达检测器的能量大,可检测10
(4)研究的光谱范围很宽 一般的色散型红外分光光度计测定的波长范围为4000~
除此之外,还有光谱范围宽(1000~
非色散型红外光度计是用滤光片,或者用滤光劈代替色散元件,甚至不用波长选择设备(非滤光型)的一类简易式红外流程分析仪。由于非色散型仪器结构简单,价格低廉,尽管它们仅局限于气体或液体分析,仍然是一种最通用的分析仪器。滤光型红外光度计主要用于大气中各种有机物质。如:卤代烃、光气、氢氰酸、丙烯腈等的定量分析。非滤光型的光度计用于单一组分的气流监测。如:气体混合物中的一氧化碳,在工业上用于连续分析气体试样中的杂质监测。显然,这些仪器主要适于在被测组分吸收带的波长范围以内,其它组分没有吸收或仅有微弱的吸收时,进行连续测定。
4.5
试样的处理和制备
要获得一张高质量的红外光谱图,除了仪器本身的因素外,还必须有合适的试样制备方法。下面分别介绍气态、液态和固态试样制备。
红外光谱的试样可以是液体、固体或气体,一般应要求:
(1)试样应该是单一组份的纯物质,纯度应>98%或符合商业规格,才便于与纯物质的标准光谱进行对照。多组份试样应在测定前尽量预先用分馏、萃取、重结晶或色谱法进行分离提纯,否则各组份光谱相互重叠,难于判断。
(2)试样中不应含有游离水。水本身有红外吸收,会严重干扰样品谱,而且会侵蚀吸收池的盐窗。
(3)试样的浓度和测试厚度应选择适当,以使光谱图中的大多数吸收峰的透射比处10%~80%范围内。
气体试样一般都灌注于玻璃气槽内进行测定。它的两端粘合有能透红外光的窗片。窗片的材质一般是NaCl或KBr。进样时,一般先把气槽抽成真空,然后在灌注试样。
1.液体池的种类
液体池的透光面通常是用NaCl或KBr等晶体做成。常用的液体池有三种,即厚度一定的密封固定池,其垫片可自由改变厚度的可拆池以及用微调螺丝连续改变厚度的密封可变池。通常根据不同的情况,选用不同的试样池。
2.液体试样的制备
(1)液膜法 在可拆池两窗之间,滴上1~2滴液体试样,使之形成一薄的液膜。液膜厚度可惜助于池架上的固紧螺丝作微小调节。该法操作简便,适用对高沸点及不易清洗的试样进行定性分析。
(2)溶液法 将液体(或固体)试样溶在适当的红外红溶剂中,如CS2、CCl4、CHCl3等,然后注入固定池中进行测定。该法特别适于定量分析。此外,它还能用于红外吸收很强、用液膜法不能得到满意谱图的液体试样的定性分析。在采用溶液去时,必须特别注意红外溶剂的选择。要求溶剂在较的范围内无吸收,试样的吸收带尽量不被溶剂吸收带所干扰,入10-10列出了红外光区常用的某些溶剂。此外,还要考虑溶剂对试样吸收带的影响(如形成氢键等溶剂效应)。
固体试样的制备,除前面介绍的溶液法外,还有压片法、粉末法、糊状法、薄膜法、发射法等,其中尤以糊状法、压片法和薄膜法最为常用。
1.压片法
这是分析固体试样应用最广的方法。通常用200
mg的KBr与1 ~ 2mg固体试样共同研磨;在模具中用5~10×107Pa压力的油压机压成透明的片后,再置于光路进行测定。由于KBr在400 ~ 4
2.糊状法
该法是把试样研细,滴入几滴悬浮剂,继续研磨成糊状,然后用可拆池测定。常用的悬浮剂是液体石蜡油,它可减小散射损失,并且自身吸收带简单,但不适于用来研究与石蜡油结构相似的饱和烷烃。
3.薄膜法
主要用于高分子化合物的测定。可将它们直接加热熔融后涂制或压制成膜。也可将试样溶解在低沸点的易挥发溶剂中,涂在盐片上,待溶剂挥发后成膜。制成的膜直接插入光路即可进行测定。
此外,当样品量特别少或样品面积特别小时,采用光束聚光器,并配有微量液体池、微量固体池和微量气体池,采用全反射系统或用带有卤化碱透镜的反射系统进行测量。
4.6 红外光谱法的应用
红外光谱在化学领域中的应用是多方面的。它不仅用于结构的基础研究,如确定分子的空间构型,求出化学键的力常数、键长和键角等;而且广泛地用于化合物的定性、定量分析和化学反应的机理研究等。但是红外光谱应用最广的还是有机化合物的定性鉴定和结构分析。
将试样的谱图与标准的谱图进行对照,或者与文献上的谱图进行对照。如果两张谱图各吸收峰的位置和形状完全相同,峰的相对强度一样,就可以认为样品是该种标准物。如果两张谱图不一样,或峰位不一致,则说明两者不为同一化合物,或样品有杂质。如用计算机谱图检索,则采用相似度来判别。使用文献上的谱图应当注意试样的物态、结晶状态、溶剂、测定条件以及所用仪器类型均应与标准谱图相同。在许多IR光谱专著中都详细地叙述各种官能团的IR光谱特征频率表,但是利用这些特征频率表来解析IR光谱,判断官能团存在与否,在很大程度上还要靠经验。因此分析工作者必须熟知基团的特征频率表,如能熟悉一些典型化合物的标准红外光谱图,则可以提高IR光谱图的解析能力,加快分析速度。
测定未知物的结构,是红外光谱法定性分析的一个重要用途。如果未知物不是新化合物,可以通过两种方式利用标准谱图进行查对:
(1)查阅标准谱图的谱带索引,与寻找试样光谱吸收带相同的标准谱图;
(2)进行光谱解析,判断试样的可能结构,然后在由化学分类索引查找标准谱图对照核实。在定性分析过程中,除了获得清晰可靠的图谱外,最重要的是对谱图作出正确的解析所谓谱图的解析就是根据实验所测绘的红外光谱图的吸收峰位置、强度和形状,利用基团振动频率与分子结构的关系,确定吸收带的归属,确认分子中所含的基团或键,进而推定分子的结构。简单地说,就是根据红外光谱所提供的信息,正确地把化合物的结构 “翻译”出来。往往还需结合其他实验资料,如相对分子质量、物理常数、紫外光谱、核磁共振波谱及质谱等数据才能正确判断其结构。
现就红外光谱解析的一般原则介绍如下:
1.收集试样的有关资料和数据
在进行未知物光谱解析之前,必须对样品有透彻的了解,例如样品的来源、外观,根据样品存在的形态,选择适当的制样方法;注意视察样品的颜色、气味等,它们住往是判断未知物结构的佐证。还应注意样品的纯度以及样品的元素分析及其它物理常数的测定结果。元素分析是推断未知样品结构的另一依据。样品的相对分子质量、沸点、熔点、折光率、旋光率等物理常数,可作光谱解释的旁证,并有助于缩小化合物的范围。
2.确定未知物的不饱和度
由元素分析的结果可求出化合物的经验式,由相对分子质量可求出其化学式,并求出不饱和度从不饱和度可推出化合物可能的范围。
不饱和度是表示有机分子中碳原子的不饱和程度。计算不饱和度W的经验公式为:
W=1+ n4
+ 1/2 (n3-n1 )
(4.7)
式中n4、n3、n1分别为分子中所含的四价、三价和一价元素原子的数目。二价原子如S、O等不参加计算。
当计算得:W=0时,表示分子是饱和的,应在 链状烃及其不含双键的衍生物;当W=1时,可能有一个双键或脂环;当W=2时,可能有 两个双键和脂环,也可能有一个叁键;当W=4时,可能有一个苯环等。
3. 图谱解析
根据官能团的初步分析可以排除一部分结构的可能性,肯定某些可能存在的结构,并初步可以推测化合物的类别。
习惯上多采用两区域法,它是将光谱按特征区:(4000~
“先特征,后指纹;先最强,后次强”指先由从特征区第一个强峰入手,因为特征区峰少,易辨认。“先粗查,后细找”,指先按待查吸收峰位,查光谱图上的八个重要区域表4.3,初步了解吸峰的起源及可能归宿,这一步可称为粗查,根据粗查提供线索,细找按基团排列的表4.4,根据此表所提供的相关位置、数目,再到未知物的光谱上去查这些相关峰,若找到所有或主要相关峰,则此吸收峰的归宿一般可以确定。关于红外光谱中常用的符号见表4.2;“先否定,后肯定”。因为吸收峰的不存在,对否定官能团的存在,比吸收峰的存在而肯定官能团的存在确凿有力。因此在粗查与细找过程中,采取先否定的办法,以便逐步缩小范围。
上述程序适用于比较简单的光谱,复杂化合物的光谱,由于多官能团间的相互作用而使得解析很困难,可先粗略解析,而后查对标准光谱定性,或进行综合光谱解析。再结合样品的其它分析资料,综合判断分析结果,提出最可能的结构式,然后用已知样品或标准图谱对照,核对判断的结果是否正确。如果样品为新化合物,则需要结合紫外、质谱、核磁等数据,才能决定所提的结构是否正确。
4. 注意事项
(1) IR光谱是测定化合物结构的,只有分子在振动的状态下伴随有偶极矩变化者才能有红外吸收。对应异构体具有相同的光谱,不能用IR光谱来鉴别这类异构体。
(2) 某些吸收峰不存在,可以确信某基团不存在;相反,吸收峰存在并不是该基团存在的确认,应考虑杂质的干扰。
(3) 在一个光谱图中的所有吸收峰并不能全部指出其归属,因为有些峰是分子作为一个整体的特征吸收,而有些峰则是某些峰的倍频或组频,另外还有些峰是多个基团振动吸收的叠加。
(4) 在4000~
(5) 在~
(6) 高聚物的光谱较之于形成这些高聚物的单体的光谱吸收峰的数目少,峰较宽钝,峰的强度也较低。但分子量不同的相同聚合物IR光谱无明显差异。如分子量为100000和分子量为15000的聚苯乙烯,两者在4000~
(7) 解析光谱图时当然首先注意强吸收峰,但有些弱峰、尖峰的存在不可忽略,往往对研究结构可提供线索。
(8) 解析光谱图时辨认峰的位置固然重要、但峰的强度对确定结构也是有用的信息。有时注意分子中两个特征峰相对强度的变化能为确认复杂基团的存在提供线索。
(9) 在实际工作中,遇到被剖析的物质不仅是单一组分,经常遇到的是二组分或多组分的样品。为了快速准确的推测出样品的组成及结构,还要借助于因子分析法、计算机技术等手段来解决实际问题。
进行定性分析时,对于能获得相应纯品的化合物,一般通过图谱对照即可。对于没有已知纯品的化合物,则需要与标准图谱进行对照。应该注意的是测定未知物所使用的仪器类型及制样方法等应与标准图谱一致。最常见的标准图谱有如下几种:
1. 萨特勒(Sadtler)标准红外光谱集
它是由美国Sadtler research laborationies编辑出版的。“萨特勒”收集的图谱最多,至1974年为止,已收集47 000张(棱镜)图谱。另外,它有各种索引,使用甚为方便。从1980年已开始可以获得萨特勒图谱集的软件资料。现在已超过130 000张图谱。它们包括9 200张气态光谱图,59 000张纯化合物凝聚相光谱和53 000张产品的光谱,如单体、聚合物、表面活性剂、粘接剂、无机化合物、塑料、药物等。
2. 分子光谱文献“DMS”(documentation of molecular spectroscopy)穿孔卡片 它由英国和西德联合编制。卡片有三种类型:桃红卡片为有机化合物,淡蓝色卡片为无机化合物,淡黄色卡片为文献卡片。卡片正面是化合物的许多重要数据,反面则是红外光谱图。
3.“API”红外光谱资料 它由美国石油研究所(API)编制。该图谱集主要是烃类化合物的光谱。由于它收集的图谱较单一,数目不多(至1971年共收集图谱3 604张),又配有专门的索引,故查阅也很方便。
事实上,现在许多红外光谱仪都配有计算机检索系统,可从储存的红外光谱数据中鉴定未知化合物。
红外光谱定量分析是通过对特征吸收谱带强度的测量来求出组份含量。其理论依据是朗伯-比耳定律。由于红外光谱的谱带较多,选择的余地大,所以能方便地对单一组份和多组份进行定量分析。
此外,该法不受样品状态的限制,能定量测定气体、液体和固体样品。因此,红外光谱定量分析应用广泛。但红外光谱法定量灵敏度较低,尚不适用于微量组份的测定。
4.6.2 .1 基本原理
1. 选择吸收带的原则
(1)必须是被测物质的特征吸收带。例如分析酸、酯、 醛、酮时,必须选择>C=O基团的振动有关的特征吸收带。
(2)所选择的吸收带的吸收强度应与被测物质的浓度有线性关系。
(3)所选择的吸收带应有较大的吸收系数且周围尽可能没有其它吸收带存在,以免干扰。
2. 吸光度的测定
(1) 一点法 该法不考虑背景吸收,直接从谱图中分析波数处读取谱图纵坐标的透过率,再由公式lg1/T=A计算吸光度。
(2)基线法 通过谱带两翼透过率最大点作光谱吸收的切线,作为该谱线的基线,则分析波数处的垂线与基线的交点,与最高吸收峰顶点的距离为峰高,其吸光度A=lg(I0/I)。
谱带强度的测量方法主要有峰高(即吸光度值)测量和峰面积测量两种,而定量分析方法很多,视被测物质的情况和定量分析的要求可采用直接计算法、工作曲线法、吸光度比法和内标法等。
1.直接计算法
这种方法适用于组分简单,特征吸收谱带不重叠。且浓度与吸收成线性关系的样品。直接从谱图上读取吸光度 A 值,再按 朗伯 -比尔定律 算出组分含量c 。这一方法的前提是应先测出样品厚度 L 及摩尔吸光系数 ε 值,分析精度不高时,可用文献报道 ε 值。
2.工作曲线法
这种方法适用于组分简单,样品厚度一定(一般在液体样品池中进行),特征吸收谱带重叠较少,而浓度与吸光度不成线性关系的样品。
3.吸光度比法
该发适用于厚度难以控制或不能准确测定其厚度的样品,例如厚度不均匀的高分子膜,糊状法的样品等。这一方法要求各组分的特征吸收谱带相互不重叠,且服从于郎伯—比尔定律。如有二元组分 X 和 Y ,根据 朗伯 -比尔定律 ,应存在以下关系;
![]()
![]()
由于是在同一被测样品中,故厚度是相同的, lX=lY
其吸光度比 R 为:
![]()
式中的 K 称为吸收系数比。前提是不允许含其他杂质。吸光度比法也适合于多元体系。
4.内标法
此法适用于厚度难以控制的糊状法 、压片法等的定量工作,可直接测定样品中某一组分的含量。具体做法如下:
首先,选择一个合适的纯物质作为内标物。用待测组分标准品和内标物配制一系列不同比例的标样,测量它们的吸光度,并用公式计算出吸收系数比 k 。
根据郎伯-比尔定律,待测组分s的吸光度: ![]()
内标物I的吸光度: ![]()
因内标物与待测组分的标准品配成标样后测定,故LS=LI
![]()
在配置的标样中cS、 cI都是已知的,As、AI可以从图谱中得到,因此可求得k值。然后在样品中配入一定量的内标物,测其吸光度,即可计算出待测组分的含量cS。
![]()
式中,k由标样求得,cI是配入样品中的内标物量,As、AI可以从谱图中得到。如果被测组分的吸光度与浓度不成线性关系,即k值不恒定时,应先做出As/AI与cs/cI工作曲线。在未知样品中测定吸光度比值后,就可以从工作曲线上得出响应的浓度比值。由于加入的内标物量是已知的,因此就可求得未知组分的含量。
[例4.1] 由元素分析某化合物的分子式为C4H6O2,测得红外光谱如图4.8所示,试推测其结构。
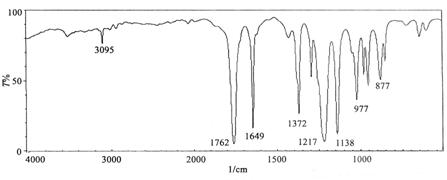
图4.8 未知物的红外光谱图
解:由分子式计算不饱和度U = 4-6/2+1= 2
特征区:3
1
这个化合物属不饱和酯,根据分子式有如下结构:
(1) CH2=CH-COO-CH3 丙烯酸甲酯
(2) CH3-COO-CH=CH2 醋酸乙烯酯
这两种结构的烯键都受到邻近基团的极化,吸收强度较高。
普通酯的vC=O在1
指纹区:δ=CH
出现在955和
由上图谱分析,化合物的结构为(2),可与标准图谱对照。
利用IR光谱可以跟踪一些化学反应,探索反应机理。酰基自由基是许多有机物在光、热分解时的中间体对该自由基的快速分析有助于理解反应的机理。IR光谱法就是一种简单方便和快速分析自由基中间体的方法。如在安息香类化合物和O-酰基-α-酮肟的光分解反应中,加入适量的CCl4,当产生酰基自由基时,则在IR光谱上可观察到酰氯的信号,证明了酰基自由基是该光反应的中间体。
在化学动力学的研究方面,IR光谱法有其独到之处。如关于聚氨酯生成的动力学研究,国内外已有不少报道,研究的主要对象是二苯甲烷二异氰酸酯(MDI)、甲苯二异氰酸酯(TDI)、1,6-乙异氰酸酯(HDI)等,而对苯二甲基二异氰酸酯(XDI)体系的研究则甚少。目前,XDI的应用已引起人们的重视,如已利用于制造皮革涂饰剂、涂料等。利用IR 光谱,通过外加内标 (KSCN)的方法研究XDI体系的聚醚型聚氨酯的动力学,可求出该体系的反应速率常数k、表观活化能E及催化活化能Ec和指前因子A。该体系为二级反应。
由于红外光谱的谱带较多,选择余地大,所以能较方便地对单组分或多组分进行定量分析。用色散型红外分光光度计进行定量分析时,灵敏度较低,尚不适于微量组分的测定。而用傅里叶变换红外光谱仪进行定量分析测定,精密度和准确度明显的优于色散型红外分光光度计。但由于红外吸收谱带较窄,外加上色散形仪器光源强度较低,以及因检测器的灵敏度低,需用宽的单色器狭缝宽度,造成使用的带宽常常与吸收峰的宽度在同一个数量级,从而出现吸收光度与浓度间的非线性关系,即偏离朗伯-比尔定律。
红外光谱法能定量测定气体、液体和固体试样。表4.6列出了用非色散型仪器定量测定大气中各种化学物质的一组数据。在测定固体试样时,常常遇到光程长度不能准确测量的问题,因此在红外光谱定量分析中,除采用紫外、可见光谱法中常采用的方法外。还采用其它一些定量分析方法。
表4.6 用非色散型仪器定量测定大气中各种化学物质
|
化 合 物 |
允许的量/μg·mL-1 |
λ/μm |
最低检测浓度/μg·mL-1 |
|
二硫化碳 氯丁二烯 乙硼烷 1,2-乙二胺 氰化氢 甲硫醇 硝基苯 吡啶 二氧化硫 氯乙烯 |
4 10 0.1 10 4.7 0.5 1 5 2 1 |
4.54 11.4 3.9 13.0 3.04 3.38 11.8 14.2 8.6 10.9 |
0.5 4 0.05 0.4 0.4 0.4 0.2 0.2 0.5 0.3 |
到目前为止,红外光谱仪的发展大体可分为三代,第一代是用棱镜作为分光元件,其缺点是分辨率低,仪器的操作环境要求恒温恒湿等;第二代是衍射光栅作为分光元件,与第一代相比,分辨率大大提高、能量较高、价格角便宜、对恒温恒湿的要求不高;第三代是傅立叶变换红外光谱仪具有高光通量、低噪音、测量速度快、分辨率高、波数准确度高、光谱范围宽等优点,扩展了红外光谱技术的应用领域。上述三代红外光谱技术一般都是指透射红外光谱技术,由于投射红外光谱技术存在如下不足:固体压片或液膜法采集制样麻烦,光程很难控制一致,给测量结果带来误差;大多数物质都有独特的红外吸收,多组分共存时,谱峰重叠现象普遍。所以,对某些样品的测试仍有较大的局限性。漫反射、衰减全反射等硬件和差谱等软件的要求,大大扩展了红外光谱技术的应用领域。
漫反射傅立叶变换红外光谱技术是一种对固体粉末样品进行直接测量的光谱方法。当光束入射至粉末状的晶面层时,一部分光在表层各晶粒面产生镜面反射;另一部分光则折射入表层晶粒的内部,经部分吸收后射至内部晶粒界面,再发生反射、折射吸收。如此多次重复,最后由粉末表层朝各个方向反射出来,这种辐射称为漫反射光,由于反射峰通常很弱,同时,它与吸收峰基本重合,仅仅使吸收峰稍有减弱而不至于引起明显的位移,对固体粉末样品的镜面反射光及漫反射光同时进行检测可得到其漫反射光谱。漫反射率和样品浓度的关系可用下式表示:
F(R∞)=(1-R∞)2/2R∞=2.303εc/S
上式叫做Kubelka-Munk方程。式中R∞表示样品厚度大于入射光透射深度时的漫反射光谱(含镜面反射);S为粉末层散射系数;c、ε分别为物质的量浓度、摩尔吸收系数。上述方程又称为漫反射光谱中的朗伯定律。由于漫反射傅立叶变换红外光谱法不需要制样、不改变样品的形状、不要求样品有足够的透明度或表面光洁度,不会对样品造成任何损坏,可直接将样品放在样品支架上进行测定,可以同时对多种组分进行测试,这些特点很适合催化的原位跟踪研究,也很适合对珠宝、纸币、邮票的真伪进行鉴定。
20世纪80年代初将显微镜技术应用到傅立叶变换红外光谱仪,诞生了全反射傅立叶变换红外光谱(ATR/FTIR)仪,ATR/FTIR使微区成分的测试和分析变得简单而快捷,检测灵敏度达数纳克(ng)测量显微区直径达数
近年来,随着仪器制造和计算机硬件、软件技术的发展,仪器的联用已成为能成功解决许多分析实际问题的、很受欢迎技术。红外光谱用于鉴别化合物,操作简便,应用广泛,但要求被测样品必须具有一定的纯度。色谱法具有高分离能力,但不具备识别化合物能力,将两种方法联用即可取长补短。现在红外光谱与气相色谱、液相色谱和超临界色谱的联用都已获得成功。其中与气相色谱的联用最为成熟,已有多种型号的商品仪器问世;超临界色谱与红外的联用潜力最大,已进行了大量的研究工作
思考题与习题
4.1红外光谱是如何产生的?红外光谱区波段是如何划分的?
4.2产生红外吸收的条件是什么?是否所有的分子振动都会产生红外吸收光谱?为什么?
4.3多原子分子的振动形式有哪几种?
4.4影响红外吸收频率发生位移的因素有哪些?
4.5傅里叶变换红外光谱仪的突出优点是什么?
4.6红外光谱区中官能团区和指纹区是如何划分的?有何实际意义?
4.7由下述力常数k数据,计算各化学键的振动频率(波数)
(1)乙烷的C—H键,k=5.1 N·cm-1;(2)乙炔的C—H键,k=5.9 N·cm-1;
(3)苯的C—C键,k=7.6 N·cm-1;(4)甲醛的C—O键,k=12.3 N·cm-1。
由所得计算值,你认为可以说明一些什么问题?
4.8判断下列各分子的碳碳对称伸缩振动在红外光谱中是活性还是非活性的。
(1)![]() (2)
(2)![]() (3)
(3)![]()
(4)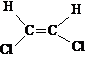 (5)
(5)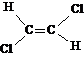
4.9试解释下列各组化合物羰基C-O伸缩振动吸收频率变化的原因。
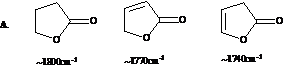
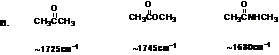
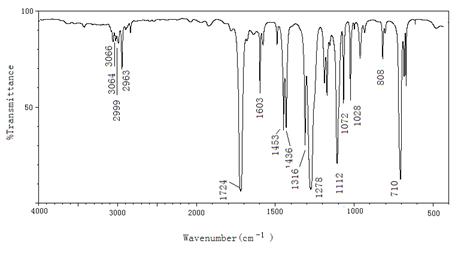
4.10某化合物分子式为C8H8O2,根据下面红外光谱,判断该化合物为苯乙酸,苯甲酸甲酯还是乙酸苯酯。
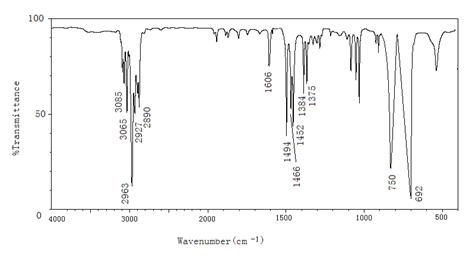
4.11化合物分子式为C9H12,不与溴发生反应,根据红外光谱图推出其结构。
4.12由下图数据试推断固体化合物C16H18的结构